
族 周期 | ⅠA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ⑨ | ① | ② | ⑧ | ||||
| 3 | ③ | ⑦ | ④ | ⑤ | ⑥ | |||
 ,故答案为:
,故答案为: ;
; ,故答案为:
,故答案为: ;
;

 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 空气 |
| △ |
| 稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
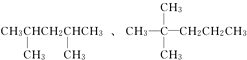
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 一定温度下,在容积为VL的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为VL的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:| a |
| b |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、天然蛋白质水解的最终产物均为α-氨基酸 |
| B、能发生酯化反应的酸不一定都是羧酸 |
| C、淀粉,纤维素,油脂都属于高分子化合物 |
| D、油脂水解得到的醇是丙三醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com