
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5微米的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样,若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离 子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol·L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断PM2.5的酸碱性为 ▲ ,试样的pH= ▲ 。
(2)为减少SO2的排放,可洗涤含SO2的烟气,下列物质可作洗涤剂的是 ▲ (填字母)。
a. Ca(OH)2 b. Na2CO3 c. CaCl2 d. NaHSO3
(3)①已知汽缸中生成NO的反应为N2(g)+O2(g) 2NO(g) ΔH>0,汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 ▲ 。
2NO(g) ΔH>0,汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 ▲ 。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g) 2C(s)+O2(g)。
2C(s)+O2(g)。
已知该反应的ΔH>0,简述该设想能否实现的依据 ▲ 。
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶
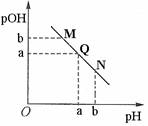 液,溶液中pOH [ pOH=-lg(OH—) ]与pH的变化
液,溶液中pOH [ pOH=-lg(OH—) ]与pH的变化
关系如图所示,则下列说法正确的是
A.M点所示溶液导电能力强于Q点
B.M点和N点所示溶液中水的电离程度相同
C. N点所示溶液中c(CH3COO-)>c(Na+)
D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
一种一元强酸HA溶液中加入一种碱MOH,溶液呈中性,下列判断正确的是
A.加入的碱过量 B.反应后溶液中c(A-)= c(M+)
C.生成的盐发生水解 D.混合前酸与碱中溶质的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,在含CH3COOH和CH3COONa均为0.1mol/L的溶液中,测得pH<7,则下列说法中正确的是
A.c(CH3COO-)<c(Na+) B. c(CH3COOH) + c(CH3COO-)=0.2mol/L
C.c(CH3COOH) > c(CH3COO-) D.c(CH3COO-)>c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:
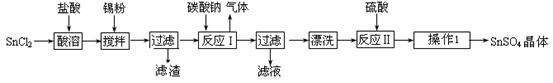
查阅资料:Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡。请回答下列问题:
(1)操作Ⅰ步骤是 ▲ 。
(2)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因 ▲ 。
(3)加入Sn粉的作用有两个:①调节溶液pH ② ▲ 。
(4)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是 ▲ 。
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是 ▲ 。
(6)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl===SnCl2 + H2↑;
②加入过量的FeCl3溶液;
③用已知浓度的K2Cr2O7滴定②中生成的Fe2+,发生的反应为:
6FeCl2 + K2Cr2O7 + 14HCl ===6FeCl3 + 2KCl + 2CrCl3 +7H2O
取1.190 g 锡粉,经上述各步反应后,共用去0.100 mol/L K2Cr2O7溶液25.00 mL。锡粉中锡的质量分数是 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
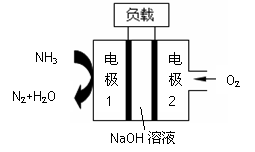
瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧
燃料电池示意图如右,有关说法正确的是
A.电池工作时,Na+ 向负极移动
B.通氨气的电极1作电池的正极
C.电子由电极2经外电路流向电极1
D.燃料电池的总反应为:4NH3+3O2=2N2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的数值,下列说法正确的是 ( )。
A.1 mol·L-1 NaCl溶液含有NA个Na+
B.1 mol Cu和足量稀硝酸反应产生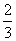 NA个NO分子
NA个NO分子
C.1 L 0.1 mol·L-1氨水含有0.1NA个OH-
D.1 mol Fe2+与足量的H2O2溶液反应,转移2NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示;

请回答下列问题:
(1)固体a的化学式为________,Ⅲ中通入足量CO2气体发生反应的离子方程式为____________________________________________________________。
(2)由Ⅴ制取铵明矾溶液的化学方程式为________________________________ _________________________________________________________________,
从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)________、冷却结晶、过滤洗涤。
(3)以1 000 kg含氧化铝36%的铝土矿为原料制取Al2(SO4)3,需消耗质量分数98%的硫酸(密度1.84 g·cm-1________L(保留一位小数)。
(4)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1∶1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com