
【题目】已知反应:2KMnO4+16HCl=2KCl+2MnCl2+5C12↑+8H2O
(1)用双线桥法标明电子转移的方向和数目。
(2)若有7.3g HCl被氧化,求体现酸性作用的HCl为多少摩?氧化产物与还原产物的质量比为多少(分子分母分别算出数值,不用约分)?
【答案】 ;0.12mol;7.1/5.04
;0.12mol;7.1/5.04
【解析】
(1)该反应中Mn从+7价降低到+2价得到5个电子,Cl从-1价升高到0价,失去1个电子,则根据电子得失守恒可知双线桥法表示反应转移的电子的方向和数目为 ;
;
(2)由反应可知,16molHCl反应时只有10molHCl作还原剂被氧化,另外6mol其酸性作用,若有7.3g HCl被氧化,n(HCl)=7.3g÷36.5g/mol=0.2mol,则体现酸性作用的HCl为![]() 。氧化产物是0.1mol氯气,还原产物是氯化锰,物质的量是0.4×0.1mo=0.04mol,二者的质量分别是0.1mol×71g/mol=7.1g、0.04mol×126g/mol=5.04g,所以二者的质量比为7.1/5.04。
。氧化产物是0.1mol氯气,还原产物是氯化锰,物质的量是0.4×0.1mo=0.04mol,二者的质量分别是0.1mol×71g/mol=7.1g、0.04mol×126g/mol=5.04g,所以二者的质量比为7.1/5.04。


科目:高中化学 来源: 题型:
【题目】关于下列四个装置的说明符合实验要求的是
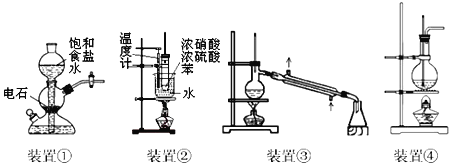
A. 装置①:实验室中若需制备较多量的乙炔可用此装置
B. 装置②:实验室中可用此装置来制备硝基苯.
C. 装置③:实验室中可用此装置来分离含碘的四氯化碳液体,最终在锥形瓶中可获得碘
D. 装置④:实验室中可用此装置来制备乙酸乙酯并在烧瓶中获得产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制Cl2反应为4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O下列说法不正确的是
MnCl2+Cl2↑+2H2O下列说法不正确的是
A. 还原剂是HCl,氧化剂是MnO2
B. 每生成1 mol Cl2,转移的电子数为2 NA
C. 转移电子的物质的量为1 mol时,生成标准状况下Cl2的体积为11.2 L
D. 每消耗1 mol MnO2,起还原剂作用的HCl消耗4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施对增大反应速率明显有效的是( )
A.Na与水反应时增大水的用量
B.Fe与稀硫酸反应制取H2时,该用浓硫酸
C.在K2SO4与BaCl2两溶液反应时,增大压强
D.Al在氧气中燃烧生成A12O3 , 将Al片改成Al粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2的燃烧热为286 kJ/mol,Li的燃烧热为299 kJ/mol。LiH可做飞船燃料,合成LiH的热化学方程式是2Li(s)+H2(g)=2LiH(s)△H=-182kJ/mol,则LiH的燃烧热为( )
A. 702 kJ/mol B. 442 kJ/mol C. 585 kJ/mol D. 351 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中金属硫化物之间存在原电池反应。下图所示装置中电极Ⅰ为方铅矿(PbS),电极Ⅱ为含有方铅矿的硫铁矿,当有电解质溶液按如图所示方向流经该装置时,电流表指针偏转。若电极Ⅱ质量不断减少,a处溶液中加入KSCN溶液未出现红色,加入CuSO4溶液未出现黑色沉淀。下列有关说法中正确的是( )
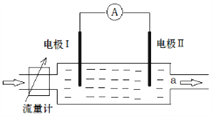
A.工业上利用该原理富集铁
B.电极Ⅱ作正极
C.溶液流经该装置后pH增大
D.该装置负极的电极反应为FeS2—15e—+8H2O=Fe3++2SO42—+16H+
查看答案和解析>>
科目:高中化学 来源: 题型:
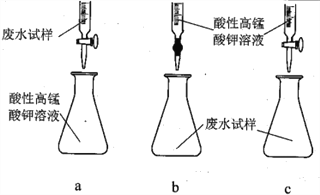
【题目】某化工厂排放的工业废水中主要含Na+、HSO3ˉ、SO42-,研究小组欲测定其中HSO3ˉ的浓度,设计如下三个方案。
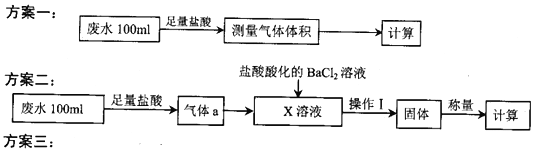
量取20.00mL废水试样,用0.02moL·K-1MnO4标准溶液进行滴定。记录数据,计算。
回答下列问题
(1)利用右图所示的装置完成方案一
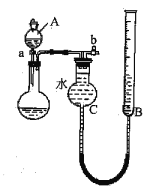
①仪器A的名称是______________。
②读数前,应进行的操作是____________________________。
③该方案存在较大的误差,可能的一种原因是____________________________。
(2)①方案二中吸收气体a的“X溶液”可能是______________ (填标号)。
a.Na2SO3溶液 b.双氧水 c.硝酸钠溶液 d.H2SO4酸化的KMnO4溶液
②若Ⅹ为次氯酸钠,写出气体a与X溶液反应的离子方程式____________________________。
③该方案中,操作I包含的操作名称依次为______________。
(3)①方案三设计的下列滴定方式中,最合理的是______________ (填标号)。该方案是否需要指示剂? ______________ (填“是”或“否”),原因是__________________________________________。
②滴定记录数据如下表:
滴定前读数/mL | 滴定后读数/mL | |
第一次 | 0.10 | 16.12 |
第二次 | 1.10 | 17.08 |
第三次 | 1.45 | 21.45 |
第四次 | 0.00 | 16.00 |
计算该废水试样中HSO3ˉ的浓度为______________ mol ·L-l。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁和石墨作电极电解酸性废水,可将废水中的PO43-以FePO4(不溶于水)的形式除去,其装置如图所示。下列说法正确的是( )
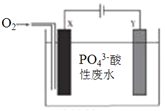
A. 若X、Y电极材料连接反了,则仍可将废水中的PO43-除去
B. X极为石墨,该电极上发生氧化反应
C. 电解过程中Y极周围溶液的pH减小
D. 电解时废水中会发生反应:4Fe2++O2+4H++4PO43- =4FePO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下现象与电化腐蚀无关的是
A. 黄铜(铜锌合金)制作的铜锣不易产生铜绿
B. 生铁比软铁芯(几乎是纯铁)容易生锈
C. 铁质器件附有铜质配件,在接触处易生铁锈
D. 银质奖牌久置后表面变暗
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com