

| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
分析 (1)仪器A为球形干燥管;无水硫酸铜吸水效率太低,一般不用作干燥剂;
(2)实验的反应条件为:无水无氧且加热,应保证实验在无水无氧环境下进行;
(3)由于TiCl4遇潮湿空气产生白雾,发生水解反应,且反应在无氧条件下进行,故E装置作用是防止空气中水蒸气、氧气进入;A装置不能吸收空气中的氧气;
(4)反应得到气体TiCl4与二氧化碳,装置气密性要好,在加装药品之前应检验装置的气密性;
(5)D中的液态混合物为TiCl4与未反应的CCl4,二者互溶,分离互溶的液体采取蒸馏方法;
(6)TiO2和焦炭、氯气在加热下反应制得TiCl4,同时有CO产生;电解发生反应:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,由转移电子根据方程式计算NaOH物质的量,再计算c(NaOH),根据c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$计算溶液中氢离子浓度,再根据pH=-lgc(H+).
解答 解:(1)仪器A为球形干燥管;碱石灰、氧化钙、烧碱具有很强的吸水性,可以用于干燥氮气,而无水硫酸铜吸水效率太低,一般不用作干燥剂,
故答案为:球形干燥管;B;
(2)实验的反应条件为:无水无氧且加热,应保证实验在无水无氧环境下进行,而装置中有空气,通入氮气的目的是:排除装置中的空气,保证反应在无水无氧环境下进行,
故答案为:排除装置中的空气,保证反应在无水无氧环境下进行;
(3)由于TiCl4遇潮湿空气产生白雾,发生水解反应,且反应在无氧条件下进行,故E装置作用是防止空气中水蒸气、氧气进入,E中盛放的试剂为浓硫酸;A装置可以吸收水,但不能不能吸收空气中的氧气,不能保证反应在无氧环境下进,故E装置不能换成A装置,
故答案为:浓硫酸;A装置不能吸收空气中的氧气,不能保证反应在无氧环境下进;
(4)反应得到气体TiCl4与二氧化碳,装置气密性要好,在加装药品之前应检验装置的气密性,
故答案为:检查装置的气密性;
(5)D中的液态混合物为TiCl4与未反应的CCl4,二者互溶,采取蒸馏方法进行分离,
故答案为:蒸馏;
(6)TiO2和焦炭、氯气在加热下反应制得TiCl4,同时有CO产生,反应方程式为:TiO2+2Cl2+2C $\frac{\underline{\;\;△\;\;}}{\;}$TiCl4+2CO;电解发生反应:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,当转移的电子数为0.1NA时,即转移电子为0.1mol,由方程式可知生成NaOH为0.1mol,反应中c(NaOH)=$\frac{0.1mol}{1L}$=0.1mol/L,故溶液中c(H+)=$\frac{1{0}^{-14}}{0.1}$mol/L=10-13mol/L,则溶液pH=-lgc(H+)=-lg10-13=13,
故答案为:TiO2+2Cl2+2C $\frac{\underline{\;\;△\;\;}}{\;}$TiCl4+2CO;13.
点评 本题考查实验制备方案,明确原理是解题关键,侧重考查学生装置的分析评价,注意对题目信息的提取与应用,是对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子的原子序数越大,原子半径越大 | |
| B. | 同族元素相差的原子序数可能为16、26、36、46 | |
| C. | I A族与ⅦA族元素间可形成共价化合物或离子化合物 | |
| D. | 碱金属单质的熔点、沸点均随着原子序数的递增而升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
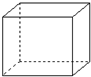 有机物的结构可用“键线式”简化表示.例如CH3-CH=CH-CH3可简写为
有机物的结构可用“键线式”简化表示.例如CH3-CH=CH-CH3可简写为  .“立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如图:
.“立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如图: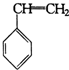 B.
B. 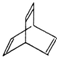 C.
C.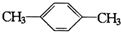 D.
D.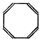
 +Br2→
+Br2→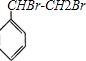 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HX>HZ>HY | B. | HZ>HY>HZ | C. | HX>HY>HZ | D. | HY>HZ>HX |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 决定反应速率的因素只有催化剂 | |
| B. | 食物放在冰箱中会减慢食物变质的速率 | |
| C. | 锌与稀硫酸反应时,加入少量水能加快产生氢气的速率 | |
| D. | 在一定条件下2mol SO2与 1mol O2混合一定能生成2mol SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
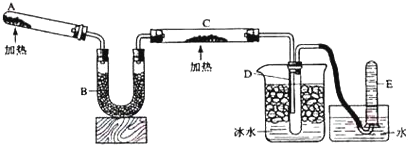
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
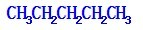 、
、 、
、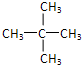 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com