
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变为H2、CO。其过程如下:
mCeO2 (m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xH2O+xCO2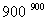 mCeO2+xH2+xCO
mCeO2+xH2+xCO
下列说法不正确的是( )
A.该过程中CeO2没有消耗
B.该过程实现了太阳能向化学能的转化

C.右图中ΔH1=ΔH2+ΔH3
D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-===CO +2H2O
+2H2O
科目:高中化学 来源: 题型:
将两个铂电极插入500 mL CuSO4溶液中进行电解,通电一定时间后,某一电极增重0.064 g(设电解时该电极无氢气析出,且不考虑水解和溶液体积变化),此时溶液中氢离子浓度约为( )
A.4×10-3 mol·L-1 B.2×10-3 mol·L-1
C.1×10-3 mol·L-1 D.1×10-7 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
依据反应事实书写热化学方程式
依据事实,写出下列反应的热化学方程式。
(1)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下2 g SiH4自燃放出热量89.2 kJ。SiH4自燃的热化学方程式为________________________________________________________________________
________________________________________________________________________。
(2)在25 ℃、101 kPa下,一定质量的无水乙醇完全燃烧时放出热量Q kJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100 g CaCO3沉淀,则乙醇燃烧的热化学方程式为________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在1 200 ℃时,天然气脱硫工艺中会发生下列反应:
H2S(g)+ O2(g)===SO2(g)+H2O(g) ΔH1
O2(g)===SO2(g)+H2O(g) ΔH1
2H2S(g)+SO2(g)=== S2(g)+2H2O(g) ΔH2
S2(g)+2H2O(g) ΔH2
H2S(g)+ O2(g)===S(g)+H2O(g) ΔH3
O2(g)===S(g)+H2O(g) ΔH3
2S(g)===S2(g) ΔH4
则ΔH4的正确表达式为( )
A.ΔH4=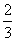 (ΔH1+ΔH2-3ΔH3)
(ΔH1+ΔH2-3ΔH3)
B.ΔH4=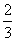 (3ΔH3-ΔH1-ΔH2)
(3ΔH3-ΔH1-ΔH2)
C.ΔH4= (ΔH1+ΔH2-3ΔH3)
(ΔH1+ΔH2-3ΔH3)
D.ΔH4= (ΔH1-ΔH2-3ΔH3)
(ΔH1-ΔH2-3ΔH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+H2O(g)===CO(g)+3H2(g)
ΔH=206.2 kJ·mol-1
CH4(g)+CO2(g)===2CO(g)+2H2(g)
ΔH=247.4 kJ·mol-1
2H2S(g)===2H2(g)+S2(g)
ΔH=169.8 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。
CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为________________________________________________________________________。
(2)H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是____________________________;燃烧生成的SO2与H2S进一步反应,生成物在常温下均非气体,写出该反应的化学方程式:_____________________________________________。
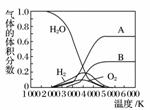
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如下图所示。图中A、B表示的物质依次是________________________。
(5)Mg2Cu是一种储氢合金。350 ℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
美国现任总统奥巴马就环境问题公开表示,到2020年,美国将会把温室气体排放量削减到1990年水平的80%,此外美国将把新能源比重提高到30%。奥巴马还计划每年拿出150亿美元大举投资太阳能、风能和生物质能源等,并且举全国之力构建美国的低碳经济领袖地位。下列说法不正确的是( )
A.CO2、甲烷都属于温室气体
B.用甘蔗生产的燃料乙醇属可再生能源,利用乙醇燃料不会产生温室气体
C.太阳能、风能和生物质能属于新能源
D.太阳能电池可将太阳能直接转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同
B.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH相同
C.已知:①2H2(g)+O2(g)===2H2O(g) ΔH1=-a kJ·mol-1,②2H2(g)+O2(g)===2H2O(l)
ΔH2=-b kJ·mol-1,则a>b
D.已知:①C(石墨,s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1,②C(金刚石,s)+O2(g)===
CO2(g) ΔH2=-395.0 kJ·mol-1,则金刚石比石墨稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
在某温度时,测得0.01 mol·L-1的NaOH溶液的pH=11。
(1)该温度下水的离子积常数Kw=______________。
(2)在此温度下,将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合。
①若所得混合液为中性,且a=12,b=2,则Va∶Vb=_____________。
②若所得混合液为中性,且a+b=12,则Va∶Vb=__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.处于最低能量的原子叫做基态原子
B.3p2表示3p能级有两个轨道
C.同一原子中,1s、2s、3s电子的能量逐渐减小
D.同一原子中,2p、3p、4p能级的轨道数依次增多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com