
| A. | 8g | B. | 16g | C. | 24g | D. | 32g |
分析 根据C和氧气的反应:C+O2=CO2①、2C+O2=2CO②可知,反应①是气体的物质的量即压强不变的反应,而反应②是气体的物质的量即压强增大2倍的反应,由于测得相同条件下的压强是反应前的1.6倍,故反应①②一定同时发生,即氧气的量不足,和9.6g碳完全反应生成CO2和CO的混合物.
9.6g碳的物质的量n=$\frac{9.6g}{12g/mol}$=0.8mol.
设氧气的物质的量为xmol,生成的CO2的物质的量为ymol,生成的CO的物质的量为zmol,根据C原子守恒、O原子守恒和压强的改变来列式解答.
解答 解:根据C和氧气的反应:C+O2=CO2①、2C+O2=2CO②可知,反应①是气体的物质的量即压强不变的反应,而反应②是气体的物质的量即压强增大2倍的反应,由于测得相同条件下的压强是反应前的1.6倍,故反应①②一定同时发生,即氧气的量不足,和9.6g碳完全反应生成CO2和CO的混合物.
9.6g碳的物质的量n=$\frac{9.6g}{12g/mol}$=0.8mol.
设氧气的物质的量为xmol,生成的CO2的物质的量为ymol,生成的CO的物质的量为zmol.
根据C原子守恒可有:y+z=0.8mol ①
根据O原子守恒可有:2y+z=2x ②
根据压强变为原来的1.6倍可有:y+z=1.6x ③
解①②③可得x=0.5mol
故氧气的质量m=nM=16g.
故选B.
点评 本题考查了根据化学方程式的有关计算,根据反应特点分析出C和氧气的反应产物中既有CO2又有CO是解题关键,难度不大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入过量Cl2:Fe2+、H+、NH4+、Cl-、SO42- | |
| B. | 加入少量NaClO溶液:NH4+、Fe2+、H+、SO42-、ClO- | |
| C. | 加入过量NaClO和NaOH的混合溶液:Na+、SO42-、Cl-、ClO-、OH- | |
| D. | 加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
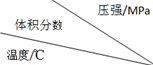 | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
| A. | 5个 | B. | 4个 | C. | 3个 | D. | 2个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 2 | 3 | 4 | 5 |
| c(NO)/10-3 mol•L-1 | 1.00 | 0.25 | 0.16 | 0.10 | 0.10 |
| c(CO)/10-3 mo l•L-1 | 3.60 | 2.85 | 2.76 | 2.70 | 2.70 |
| A. | 0~2 s间的平均反应速率v(NO)=3.75×10-3mol/(L•s) | |
| B. | 催化转化器对废气的转化速率在冬季时比夏季时高 | |
| C. | 选用更有效的催化剂可以提高污染物的转化率 | |
| D. | 该温度下,此反应的平衡常数K=5.0×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | x值为1 | B. | 混合气体的密度增大 | ||
| C. | 平衡时N的浓度为 0.6 mol/L | D. | N的转化率为80% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ/mol | |
| B. | 一定条件下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3放热akJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-2akJ/mol | |
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol | |
| D. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=-114.6kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com