
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源:不详 题型:单选题
| A.NaClO3是还原剂 |
| B.氧化性:ClO2>NaClO3 |
| C.化学反应方程式为:2NaClO3 + Na2SO3 + H2SO4 = 2ClO2 + 2Na2SO4 + H2O |
| D.1 mol NaClO3参加反应有2 mol e-转移 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NH4F的还原性比NH3强 |
| B.NF3的氧化性比F2强 |
| C.该反应中被氧化和被还原物质的物质的量之比为4∶3 |
| D.该反应中得到1 mol NF3时,转移6 mol电子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 3HNCO; 8HNCO+6NO2
3HNCO; 8HNCO+6NO2 7N2+8CO2+4H2O,下列说法正确的是:( )
7N2+8CO2+4H2O,下列说法正确的是:( )| A.C3N3(OH)3与HNCO为同一物质 | B.HNCO是一种很强的氧化剂 |
| C.1 mol NO2在反应中转移的电子为4 mol | D.反应中NO2是还原剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)> SeO2> I2。 |
| B.①中Se是氧化产物,I2是还原产物 |
| C.反应①中KI是氧化剂,SeO2是还原剂 |
| D.反应①中每有1.0 mol I2生成,转移电子数目为4NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2O2的氧化氢比Fe3+强,其还原性比Fe2+弱 |
| B.在H2O2分解过程中,溶液的pH逐渐下降 |
| C.在H2O2分解过程中, Fe2+和Fe3+的总量减少 |
| D.H2O2生产过程要严格避免混入Fe2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.上述反应中氧化剂和还原剂的物质的量之比为5:6 |
| B.产生白色烟雾的原因是生成的P205白色固体小颗粒(烟)吸水性很强,吸收空气中的水分,生成磷酸小液滴(雾)形成气溶胶 |
| C.上述反应中消耗3 mol P时,转移电子的物质的量为15mol |
| D.因红磷和白磷互为同素异形体,所以上述火药中的红磷可以用白磷代替 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
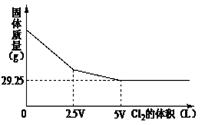
| A.52.5g | B.60g | C.45g | D.37.5g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com