
【题目】科学家从化肥厂生产的(NH4)2SO4中检出组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42- 和N4H44+ 两种离子形式存在,植物的根系极易吸收N4H44+,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。请回答下列问题:
(1)下列相关说法中,正确的是________(填序号)。
a.N4是N2的同分异构体
b.1 mol N4分解生成N2,形成了4 molπ键
c.白磷的沸点比N4高,是因为P-P键键能比N-N键能大
d.白磷的化学性质比N2活泼,说明P的非金属性比N强
(2)叠氮化物是研究较早的含全氮阴离子的化合物,如:氢叠氮酸(HN3)、叠氮化钠(NaN3)等。根据等电子体理论写出N3- 的电子式_______;叠氮化物能形成多种配合物,在[Co(N3)(NH3)5]SO4,其中钴显 ____ 价,它的配体是 __________
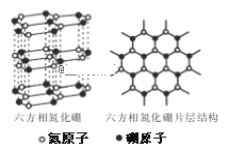
(3)六方相氮化硼晶体内B-N键数与硼原子数之比为_______。
【答案】b ![]() +3 N3-、NH3 3:1
+3 N3-、NH3 3:1
【解析】
(1)a.N4和N2是氮元素组成的结构不同的单质,二者互为同素异形体;
b.1mol N4分解生成2mol N2,N2的结构式为N≡N,三键中含有1个σ键、2个π键;
c.白磷、N4晶体都属于分子晶体,沸点高低与分子间作用力有关,与化学键无关;
d.白磷的化学性质比N2活泼,说明P-P键不如N-N稳定;
(2)原子总数相等、价电子总数也相等的微粒互为等电子体,N3-与CO2互为等电子体,二者价键结构相同;N3-为-1价、SO42-为-2价、NH3的化合价为0,根据化合价规则确定Co的价态;中心原子或离子具有空轨道,配体含有孤电子对;
(3)每个六元环上有3个B原子、3个N原子,有6个B-N键,而每个B-N键为一个六元环贡献率为![]() ,每个B原子为一个六元环贡献率为
,每个B原子为一个六元环贡献率为![]() ,利用均摊法计算;晶体导电需要有自由移动电子。
,利用均摊法计算;晶体导电需要有自由移动电子。
(1)a.分子式相同、结构不同的化合物互为等电子体,而N4和N2是氮元素组成的结构不同的单质,二者互为同素异形体,a错误;
b.1mol N4分解生成2mol N2,N2的结构式为N≡N,三键中含有1个σ键、2个π键,则产生2molN2时形成了4mol π键,b正确;
c.白磷、N4晶体都属于分子晶体,白磷的沸点比N4高,是由于白磷分子间作用力比N4的强,与化学键键能无关,化学键键能影响化学性质,c错误;
d.白磷的化学性质比N2活泼,说明P-P键不如N-N稳定,而P的非金属性比N的弱,d错误,
故合理选项是b;
(2)N3-与CO2互为等电子体,二者价键结构相同,N3-的电子式为:![]() ;N3-为-1价、SO42-为-2价、NH3的化合价为0,设配合物中Co的化合价为a,则a+(-1)+0+(-2)=0,解的a=+3;中心原子或离子具有空轨道,配体含有孤电子对,[Co(N3)(NH3)5]SO4中配位体为:N3-、NH3;
;N3-为-1价、SO42-为-2价、NH3的化合价为0,设配合物中Co的化合价为a,则a+(-1)+0+(-2)=0,解的a=+3;中心原子或离子具有空轨道,配体含有孤电子对,[Co(N3)(NH3)5]SO4中配位体为:N3-、NH3;
(3)每个六元环上有3个B原子、3个N原子,有6个B-N键,而每个B-N键为一个六元环贡献率为![]() ,每个B原子为一个六元环贡献率为
,每个B原子为一个六元环贡献率为![]() ,六元环单独占有B-N数目为6×
,六元环单独占有B-N数目为6×![]() =3,单独占有B原子数为3×
=3,单独占有B原子数为3×![]() =1,所以B-N键数与硼原子数之比为3:1。
=1,所以B-N键数与硼原子数之比为3:1。


 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】(1)某实验小组同学进行如图所示实验,以检验化学反应中的能量变化。
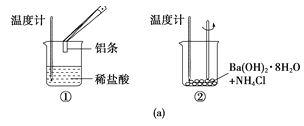
实验发现,反应后①中的温度升高,②中的温度降低。由此判断铝条与盐酸的反应是__(填“吸热”或“放热”,下同)反应,Ba(OH)2·8H2O与NH4Cl的反应是__反应。反应__(填“①”或“②”)的能量变化可用图(b)表示。
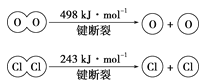
(2)已知:4HCl+O2=2Cl2+2H2O,该反应中,4molHCl被氧化,放出115.6kJ的热量,则断开1molH—O键与断开1molH—Cl键所需能量相差约为__kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予约翰·古德伊纳夫、斯坦利·惠廷厄姆和吉野彰三位科学家,以表彰他们在锂电池领域所做出的巨大贡献。请回答下列问题:
(1)LiCoO2、LiFePO4常用作锂离子电池的正极材料。基态Co原子核外电子排布式为___,基态磷原子中,电子占据的最高能层符号为___;该能层能量最高的电子云在空间有___个伸展方向,原子轨道呈___形。
(2)[Co(NO3-)4]2-中Co2+的配位数为4,配体中N的杂化方式为__,该配离子中各元素的第一电离能由小到大的顺序为___(填元素符号),1mol该配离子中含σ键数目为___NA。
(3)LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示:
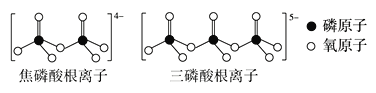
这类磷酸根离子的化学式可用通式表示为___(用n代表P原子数)。
(4)钴蓝晶体结构如图,该立方晶胞由4个I型和4个Ⅱ型小立方体构成,其化学式为___,晶体中Al3+占据O2-形成的___(填“四面体空隙”或“八面体空隙”)。NA为阿伏加德罗常数的值,钴蓝晶体的密度为___g·cm-3(列计算式)。
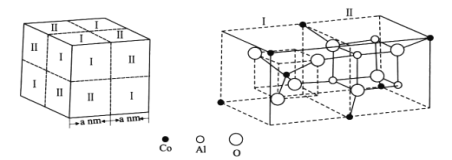
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )

A.图中a和b分别为T1、T2温度下CdS在水中的溶解度
B.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q)
C.向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动
D.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCl3·4NH3用H2SO4溶液处理再结晶,SO42-可以取代化合物中的Cl-,但NH3的含量不变,用过量的AgNO3处理该化合物,有含量三分之一的氯以AgCl析出,这种化合物应该是( )
A. [Co(NH3)4]Cl3B. [Co(NH3)4Cl3]C. [Co(NH3)4Cl2]ClD. [Co(NH3)4Cl]Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种芳香族化合物都是某些植物挥发油中的主要成分,有的是药物,有的是香料,它们的结构简式如下所示:

请回答下列问题:
(1)用A、B、C、D填空:
①既能使FeCl3溶液显色又能和NaHCO3溶液反应放出气体的有__________。
②能发生银镜反应的有__________。
(2)1molB最多能与_____molBr2发生反应,C中所含官能团的名称为________;
(3)按下图C经一步反应可生成E,E是B的同分异构体.则反应①属于____________反应
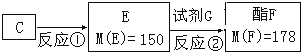
E到F转化过程中除用到催化剂外,还用到一种试剂G是_________(写结构简式)
(4)写出反应①的化学方程式:________;反应②的化学方程式:_________。
(5)同时符合下列两项要求的D的同分异构体有4种:
①化合物是1,2-二取代苯;
②苯环上的两个取代基分别为羟基和含有-COO-结构的基团。其中两种(G和H)结构简式如下图所示,请补充另外两种。
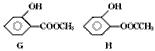
____________、______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,W在大气中有两种同素异形体且均能支持燃烧,X的原子半径是所有短周期主族元素中最大的,非金属元素Y的原子序数是Z的最外层电子数的2倍。下列叙述不正确的是( )
A.Y、Z的氢化物稳定性Y>Z
B.Y单质的熔点高于X单质
C.X、W、Z能形成具有强氧化性的XZW
D.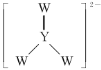 中W和Y都满足8电子稳定结构
中W和Y都满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成有机化合物D的过程如下:
![]()
下列相关说法中错误的是
A. 1 mol B→1 mol C消耗2 mol NaOH
B. 反应③的反应温度是170℃
C. 反应①、②、③的反应类型依次为加成反应,水解反应,取代反应
D. 反应③还有副产物:HOCH2CH2OCH2CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,1L 1mol/LHF溶液中含HF分子数目为NA
B.2CO2(g)+6H2(g) ![]() CH3CH2OH(g)+3H2O(g) △H=-a kJ·mol-1,将2mol CO2和6mol H2在一密闭容器中按照上述反应充分反应放出a kJ的热量
CH3CH2OH(g)+3H2O(g) △H=-a kJ·mol-1,将2mol CO2和6mol H2在一密闭容器中按照上述反应充分反应放出a kJ的热量
C.78gNa2O2固体中含阴离子数目为NA
D.25g质量分数68%的H2O2水溶液中含氧原子数目为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com