
【题目】电气石是一种具有保健作用的天然石材,其中含有的主要元素为B、Si、Al、Mg、Na、O等元素。
(1)上述元素中,原子半径最小的是_________(用元素符号表示),在元素周期表中处于金属和非金属分界线附近的元素是_____________(用元素符号表示);
(2)表示原子结构的化学用语有:原子结构示意图、核外电子排布式、轨道表示式,从中选择最详尽描述核外电子运动状态的方式,来表示氧元素原子核外电子的运动状态______________;
(3)B与最活泼的非金属元素F形成化合物BF3,检测发现BF3分子中三根B—F键的键长相等,三根键的键角相等,能否仅仅依据此数据此判断BF3分子的极性____________;
(4)SiO2晶体的熔点比BF3晶体________(选填“高”、“低”)。
【答案】O B、Si、Al ![]() 非极性 高
非极性 高
【解析】
(1)同周期自左而右原子半径减小,电子层越多原子半径越大;在元素周期表中处于金属和非金属分界线附近的元素是B、Si、Al;
(2)最详尽描述核外电子运动状态的方式为核外电子轨道排布式,根据核外电子排布规律画出;处于不同能级的电子,能量不同,处于同一能级不同轨道的电子能量相同;
(3)BF3分子中三根B﹣F键的键长相等且键角也相等,为平面正三角形结构,正负电荷重心重合;根据晶体类型判断熔点高低,一般熔点:原子晶体>离子晶体>分子晶体;
(4)BF3是分子晶体,SiO2是原子晶体。
(1)同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径Na>Mg>Al>Si>B>O,在元素周期表中处于金属和非金属分界线附近的元素是B、Si、Al;
(2)最详尽描述核外电子运动状态的方式为核外电子轨道排布式,氧元素原子核外电子轨道排布式为:![]() ;
;
(3)BF3分子中三根B﹣F键的键长相等且键角也相等,为平面正三角形结构,正负电荷重心重合,为非极性分子;
(4)BF3是分子晶体,SiO2是原子晶体,故SiO2晶体的熔点比BF3晶体高。


科目:高中化学 来源: 题型:
【题目】有一烃A,能发生如图所示的一系列转化:

已知两个E分子间可发生缩合反应生成环状化合物C6H8O4,试解答下列问题:
(1)写出A和E的结构简式__、__。
(2)在反应①﹣⑦属于取代反应的有__。
(3)写出下列反应的化学方程式:
反应①__。
反应④__。
反应⑦__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或试剂的选择都合理的是
A.减压过滤时,常用倾析法先转移上部清液,溶液量不超过漏斗容量的2/3,慢慢开大水龙头,待溶液快流尽时再转移下部沉淀
B.用酸性高锰酸钾溶液检验FeCl2和FeCl3混合液中的Fe2+
C.用NaOH溶液除去溶在乙酸乙酯中的乙酸
D.向CoCl2溶液中逐滴加入浓盐酸并振荡,溶液的颜色会从蓝色逐渐变成粉红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四期某些过渡元素在工业生产中有着极其重要的作用。
(1)铬是最硬的金属单质,被称为“不锈钢的添加剂”。
写出Cr在周期表中的位置___________;其原子核外电子排布的最高能层符号___________.
(2)在1 mol CrO5(其中Cr为+6价)中,含有过氧键的数目为___________。
(3)钒(23V)是我国的丰产元素,被称之为“工业的味精”,广泛用于催化及钢铁工业。回答下列问题:
写出钒原子价电子排布图___________;V2O5常用作SO2转化为SO3的催化剂。SO3的三聚体环状结构如图所示,该结构中S原子的杂化轨道类型为___________;
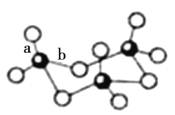
(4)Ni是一种优良的有机反应催化剂,Ni能与CO形成正四面体形的配合物Ni(CO)4,其中配原子是___________。
(5)钛称之为21世纪金属,具有一定的生物功能。钙钛矿(CaTiO3)晶体是工业获取钛的重要原料。 CaTiO3晶胞如下图,边长为a=0.266m,晶胞中Ti、Ca、O分别处于顶角、体心、面心位置。Ti与O间的最短距离为___________nm,与Ti紧邻的O个数为___________。
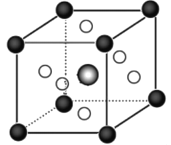
(6)在CaTiO3晶胞结构的另一种表示中,Ca处于各顶角位置,则T处于___________位置,O处于___________位置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2000年诺贝尔化学奖授予两位美国化学家和一位日本化学家,以表彰他们在导电塑料领域的贡献,他们首先把聚乙炔树脂制成导电塑料。下列关于聚乙炔的叙述错误的是( )
A.聚乙炔是以乙炔为单体发生加聚反应形成的高聚物
B.聚乙炔的化学式为![]() 分子中所有碳原子不可能在同一直线上
分子中所有碳原子不可能在同一直线上
C.聚乙炔是一种碳原子之间以单双键交替结合的链状结构的物质
D.聚乙炔树脂不加任何填充物即可成为电的良导体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20gA全部溶于0.15L 6.0molL-1盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12L(标况)气体。同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检查时,溶液D不变色。
请填空:
(1)①中引发铝热反应的实验操作是_________________________________________,产物中的单质是___________。
(2)②中所发生的各反应的化学方程式是_______________________________________。
(3)③中所发生的各反应的离子方程式是 _________________________。
(4)若溶液D的体积仍视为0.15L,则该溶液中c(Mg2+)为 _______________。c(Fe2+)为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。说法正确的是

A.元素非金属性:X>R>W
B.X与R形成的分子内含两种作用力
C.X、Z形成的化合物中可能含有共价键
D.元素对应的离子半径:W>R>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小型化工厂生产皓矾(ZnSO4·7H2O)的工艺流程如下图所示:

已知:开始生成氢氧化物沉淀到沉淀完全的pH范围分别为Fe(OH)3:2.7~3.7;Fe(OH)2:7.6~9.6;Zn(OH)2:5.7~8.0。
试回答下列问题:
(1)加入的试剂①应是________,其目的是____________________________________。
(2)加入的试剂②,供选择使用的有:氨水、NaClO溶液、20% H2O2溶液、浓硫酸、浓硝酸等,应选用________,其理由是_____________________。
(3)加入的试剂③是________,目的是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
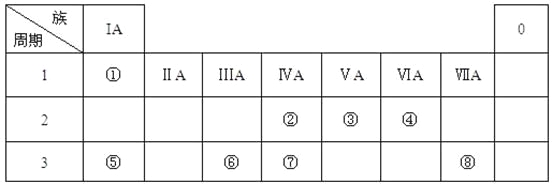
(1)④、⑤、⑥的原子半径由大到小的顺序为______________。
(2)②、⑧、⑦的最高价含氧酸的酸性由强到弱的顺序是__________。
(3)③的气态氢化物的电子式_____。
(4)⑤的最高价氧化物对应水化物的溶液与单质⑥、单质⑧分别反应的离子方程式___、____。
(5)单质①在单质⑧中燃烧,火焰为__________色。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com