
| 选项 | X | Y | Z |
| A | Cu | HNO3 | Fe(NO3)3 |
| B | FeCl3 | Zn | NaHCO3 |
| C | O2 | NH3 | SO2 |
| D | NH4Al(SO4)2 | Ba(NO3)2 | NaOH |
| A. | A | B. | B | C. | C | D. | D |
分析 根据两种化合物通过交换成分生成另外两种化合物的复分解反应的定义,利用复分解反应为两化合物相互交换成分而发生反应的特点,判断反应为复分解反应,氧化还原反应一定不属于复分解反应.
A.单质与化合物的反应不属于复分解反应;
B.氯化铁和锌反应不属于复分解反应;
C.氨气和氧气反应、氧气和二氧化硫反应都属于氧化还原反应;
D.硫酸铝铵和硝酸钡反应生成硫酸钡沉淀,硫酸铝铵和氢氧化钠反应生成氢氧化铝.
解答 解:A.铜为单质,与硝酸反应、以及铜和硝酸铁的反应都不是复分解反应,故A错误;
B.2FeCl3+Zn=ZnCl2+2FeCl2,该反应属于氧化还原反应,不属于复分解反应,故B错误;
C.4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,该反应属于氧化还原反应,氧气和二氧化硫反应属于氧化还原反应,两反应都不属于复分解反应,故C错误;
D.NH4Al(SO4)2+Ba(NO3)2=BaSO4↓+NH4NO3+Al(NO3)3,属于复分解反应,2NH4Al(SO4)2+6NaOH=3Na2SO4+(NH4)2
SO4+2Al(OH)3↓,属于复分解反应,故D正确;
故选D.
点评 本题考查物质的性质及反应,为高频考点,把握物质的性质、发生的反应、反应分类为解答的关键,侧重分析与应用能力的考查,注意基本反应类型的判断,题目难度不大.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸雕刻玻璃:Si+4HF═SiF4↑+2H2↑ | |
| B. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | |
| C. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| D. | 澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 13 | C. | 12 | D. | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
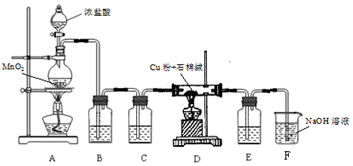
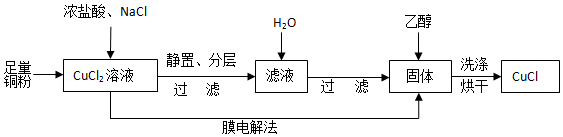
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
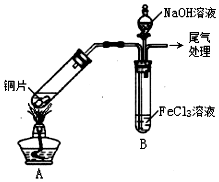 某化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去)
某化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
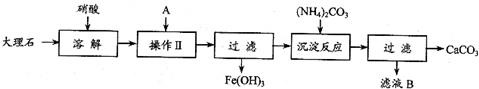
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
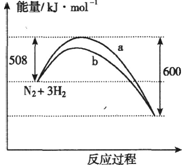
| A. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92kJ•mol-1 | |
| B. | a曲线是加入催化剂时的能量变化曲线 | |
| C. | 加入催化剂,该化学反应的反应热改变 | |
| D. | 在温度体积一定的条件下,通入1mol N2和3 mol H2反应后放出的热量为69kJ,则N2的转化率为75% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 25% | C. | 30% | D. | 75% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com