
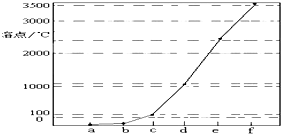
 如图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体.
如图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体.分析 Na、Cu、Si、H、C、N等元素单质中,Na、Cu为金属晶体,均是热和电的良导体,C、Si的单质为原子晶体,且C单质的熔沸点大于Si原子晶体的熔沸点,H、N对应的单质为分子晶体,其中氢气的熔点最低,由图熔点的高低顺序可知a为H,b为N,c为Na,d为Cu,e为Si,f为C,结合对应单质、化合物的结构和性质以及元素周期律的递变规律解答该题,
(1)d为Cu,Cu元素为29号元素,原子核外有29个电子,根据核外电子排布规律来写;
(2)单质a、b、f对应的元素以原子个数比1:1:1形成的分子为HCN,C-Hσ键和1个C-N1个σ键和2个π键;
(3)a与b的元素形成的10电子中性分子X为NH3,根据价电子对互斥理论确定微粒的空间构型,与铜离子配位形成四氨合铜络离子.
解答 解:Na、Cu、Si、H、C、N等元素单质中,Na、Cu为金属晶体,均是热和电的良导体,C、Si的单质为原子晶体,且C单质的熔沸点大于Si原子晶体的熔沸点,H、N对应的单质为分子晶体,其中氢气的熔点最低,由图熔点的高低顺序可知a为H,b为N,c为Na,d为Cu,e为Si,f为C,
(1)d为Cu,对应元素原子的电子排布式:1s22s22p63s23p63d104s1,故答案为:1s22s22p63s23p63d104s1;
(2)单质a、b、f对应的元素以原子个数比1:1:1形成的分子为HCN,结构式为H-C≡N,C-Hσ键和1个C-N1个σ键和2个π键,所以分子中含2个σ键,2个π键,
故答案为:2;2;
(3)a与b的元素形成的10电子中性分子X为NH3,氨气分子中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(5-3×1)=4,所以氮原子杂化方式是sp3,因为含有一个孤电子对,所以是三角锥型结构,将NH3溶于水后的溶液滴入到含Cu元素高价离子的溶液中至过量,Cu2+提供空轨道,氨气分子提供孤对对子,通过配位键形成四氨合铜络离子,其化学式为[Cu(NH3)4]2+,
故答案为:三角锥型;[Cu(NH3)4]2+;配位.
点评 本题是对物质结构的考查,涉及核外电子排布、杂化轨道、配合物等,根据图示推出各对应元素是解答关键,需要学生具备扎实的基础,题目难度中等.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:解答题

 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯分子中的6个碳原子之间的键完全相同,是一种介于碳碳单键和碳碳双键之间的独特的键 | |
| B. | 将溴水加入苯中,震荡,溴水的颜色变浅,这是由于发生了加成反应 | |
| C. | 乙烷和丙烯的混合物共1 mol,完全燃烧生成3 mol H2O | |
| D. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
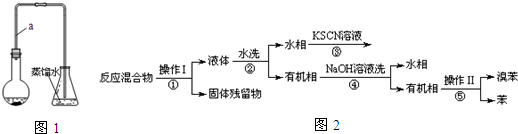
| 实验步骤 | 预期现象 | 结论 |
| 1.将锥形瓶中的液体转入分液漏斗,加足量①四氯化碳,振荡后分液.分别取少量②上层溶液于试管A、B中 | ||
| 2.向试管A中加入少量③和四氯化碳,振荡后静置; | 溶液分层,下层显④红棕(橙红色也可以)色 | 锥形瓶中液体含大量Br- |
| 3.向试管B中加入⑤镁粉. | 有汽泡生成 | 锥形瓶中液体含大量⑥H+ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大反应物浓度,可增大单位体积内活化分子百分数,使有效碰撞次数增大 | |
| B. | 有气体参加的化学反应,若缩小反应容器的体积,可增加活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使化学反应速率增大,主要原因是增加了活化分子的百分数 | |
| D. | 催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 事实 | 结论 |
| A.甲乙两种物质,相对分子质量相同,结构不同 | 甲和乙一定是同分异构体 |
| B.灼烧棉织品、羊毛衫和涤纶衣物 | 有烧焦羽毛气味的是羊毛衫 |
| C.在淀粉溶液中加入市售的加碘食盐不出现蓝色 | 不能说明此盐不含碘元素 |
| D.完全燃烧产物是CO2和H2O的物质 | 一定只含C、H元素 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用氯化铵和氢氧化钠固体制NH3 | B. |  用铜片和稀硝酸制NO | ||
| C. | 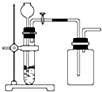 用锌粒和稀硫酸制H2 | D. | 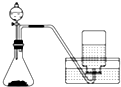 用H2O2和MnO2制O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 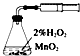 装置测定化学反应速率 | B. | 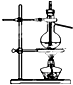 装置模拟海水蒸馏 | ||
| C. | 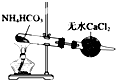 装置制备纯净的NH3 | D. |  装置比较MnO2、Cl2、S的氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com