
【题目】298K时向20mL0.1mol·L-1MOH 溶液中滴加0.1mol·L-1CH3COOH溶液,所得溶液的pH 及导电能力变化如图所示,下列叙述正确的是( )
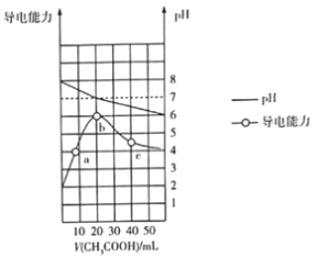
A. MOH 是强电解质
B. b点对应的盐不水解
C. c 点溶液中:c(CH3COO-)>c(M+)>c(H+)>c(OH-)
D. a 点溶液中:c(OH-)+c(CH3COO-)+)+c(M+)
【答案】C
【解析】试题分析:由图像可知,0.1mol·L-1MOH溶液的pH为8而不是13,说明MOH是弱碱,故其为弱电解质。在a点溶液中有OH-、CH3COO-、H+、M+等4种离子,由电荷守恒可知,OH-)+c(CH3COO-)=c(H+)+c(M+)。在b点,两者恰好完全反应生成弱酸弱碱盐CH3COOM,该盐水解后溶液的pH=6,溶液显弱酸性,说明M+的水解程度大于CH3COO-的水解程度,所以在b点溶液中c(CH3COO-)>c(M+)>c(H+)>c(OH-)。在c点,醋酸过量使溶液酸性增强,依据电荷守恒可以判断,溶液中c(CH3COO-)>c(M+)>c(H+)>c(OH-)。在一定温度下,水的离子积是定值,其值不随溶液的pH变化而变化。综上所述,C正确,本题选C。


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法正确的是( )
A. 常温常压下,11.2L CO2所含的原子数为1.5NA
B. 标准状况下,22.4L H2和N2的混合物中所含原子数为NA
C. 标准状况下,11.2L SO3 中含有2NA个原子
D. 3mol单质Fe完全转变为Fe3O4,失去8NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与平衡移动原理无关的是
A. 向含酚酞的Na2CO3溶液中滴加BaCl2溶液,红色变浅
B. 加热MgCl2·6H2O固体最终得到Mg(OH)Cl
C. 将FeS2矿石粉碎更有利于焙烧制备SO2气体
D. NO2气体经过冷凝和加压成无色液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组以废铁屑、稀硫酸、饱和(NH4)2SO4溶液为原料,经过一系列反应和操作后,合成了浅蓝绿色晶体X。为确定其组成,进行如下实验:
Ⅰ.结晶水的测定:称取7.84 g浅蓝绿色晶体,加热至100 ℃失去结晶水,冷却至室温后,称重,质量为5.68 g。
Ⅱ.NH4+的测定:将上述5.68 g固体置于如图所示的三颈瓶中,然后逐滴加入足量10%的NaOH溶液,通入氮气,用40.00 mL 1 mol·L-1的硫酸溶液吸收产生的氨气。吸收氨气结束后取下接收瓶,用2 mol·L-1NaOH标准溶液滴定过剩的硫酸,到终点时消耗20.00 mL NaOH溶液。
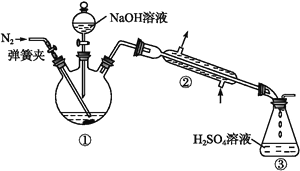
Ⅲ.铁元素的测定:将上述实验结束后三颈瓶中的溶液全部倒入锥形瓶中,向其中加入适量3%的H2O2溶液,充分振荡后滤出沉淀,洗净、干燥、灼烧后;测得其质量为1.6 g。回答下列问题:
(1)在实验Ⅰ中,不可能用到的实验仪器是_____(填正确答案标号)。
A.烧杯 B.铁架台(带铁圈) C.坩埚 D.蒸发皿 E.酒精灯 F.干燥器 G.托盘天平
(2)在实验Ⅱ中,通入氮气的目的是____________。吸收氨气结束后,为了减少实验误差,还需要对直形冷凝管进行“处理”,“处理”的操作方法是_______________。
(3)在实验Ⅱ中,用NaOH标准溶液滴定过剩的硫酸时,应使用_______式滴定管;可使用的指示剂为_______________。
(4)在实验中,检验沉淀是否洗净的方法是____________________。
(5)根据上述实验数据计算,该浅蓝绿色晶体的化学式为________。三颈瓶中发生反应的离子方程式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,22.4LN2和H2混合气中含2NA 个原子
B. 78gNa2O2与足量的CO2完全反应,转移的电子数为2NA
C. 1 L1 mol·L-1NH4Cl溶液中,NH4+的数量为NA
D. 室温下, pH=13的NaOH 溶液中,则溶液中 OH- 离子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的KOH溶液,分别滴定浓度均为0.1 mol·L1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示,下列判断正确的是
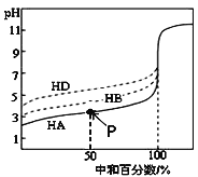
A. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(H+)+c(OH)
B. 滴定至P点时,溶液中:c(K+)> c(A)> c(HA)> c(H+)> c(OH)
C. 同浓度的KA、KB、KD三种盐溶液的pH大小关系:pH(KD)< pH(KB)< pH(KA)
D. 当三种酸都中和至中性时,消耗KOH溶液的体积的大小关系为:V(HA) > V(HB) > V(HD)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修5:有机化学基础)
氯贝特( )是临床上一种抗血栓药物.它的一种合成路线如下(图中部分反应条件及部分反应物、生成物已略去)。
)是临床上一种抗血栓药物.它的一种合成路线如下(图中部分反应条件及部分反应物、生成物已略去)。

回答下列问题:
(1)有机物F的分子式为______________,其核磁共振氢谱有______________个峰,该物质中含有的官能团名称为_____________________。
(2)C的结构简式为_________,要实现反应I的转化,加入下列物质能达到目的是________。
a.Na b.NaHCO3 c.NaOH d. Na2CO3
(3)写出反应Ⅲ的化学方程式____________________________________________________,反应Ⅲ的反应类型为_______________________。
(4)产物E有多种同分异构体,满足下列条件的所有同分异构体Y有______________种。
① 属于酯类且与FeCl3溶液显紫色 ② 能发生银镜反应
③苯环上只有2个取代基且处于对位 ④ 1molY最多与2molNaOH反应
(5)结合以上合成路线信息,设计以CH3CH2COOH为原料(无机试剂任选),合成有机物![]() 的合成路线____________________________________________________。
的合成路线____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积KW | 1×10-14 | 1×10-13 | 1×10-12 |
试回答以下问题:
(1)在t2℃下,将amol·L-1CH3COOH溶液与bmol·L-1NaOH客液等体积混合反应后,溶液恰好呈中性,则该温度下CH3COOH 的电离常数Ka=_______(用a、b 表示)。
(2)25℃时,有pH=4的醋酸溶液和氯化氨溶液,醋酸中水电离高出的H+浓度与氯化氨溶液中水电离出的H+浓度之比是_______。
(3)25℃时,向体积为VamLpH=3的醋酸溶液中滴加pH=11的NaOH溶液VbmL 至溶液恰好呈中性,则Va与的Vb关系是Va_______Vb (填“>”、“<”或“=”)。
(4)醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,下列叙述不确的是(______)
CH3COO-+H+,下列叙述不确的是(______)
a.CH3COOH 溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
b.0.1mol/L的CH3COOH 溶液加水稀释,溶液中c(OH-)减小
c.CH3COOH溶液中加入少量CH3COONa固体,平衡逆向移动
d.常温下,pH=2的CH3COOH溶液与pH=12的NaOH 溶液等体积混合后溶液的pH<7
e .室温下,向pH=3的醋酸溶液中加水稀释,溶液中![]() 不变
不变
Ⅱ.某镁盐溶液中含有杂质离子Cr3+,所含主要离子及其浓度如下表所示(H+和OH-未列出):
离子 | Mg2+ | Cr3+ | Cl- |
浓度(mol·L-1) | 0.5 | 0.01 | a |
已知25℃时,KspCr(OH)3=10-32;KspMg(OH)2=5×10-11;操作过程中溶液体积的变化忽略不计。
(5)表格中的a___________1.03(填“<”、“>”或“=”)。
(6)除去杂质Cr3+离子,可加入MgO调节溶液pH, 理论上应调节pH的范围是_______。
(7)溶液经除杂、过滤后,由滤液制取氯化镁晶体(MgCl2·6H
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G是一种医药中间体,可通过下图所示路线合成,A是石油化工的重要产品且分子中所有原子在同一平面上,H的分子式是C7H8。
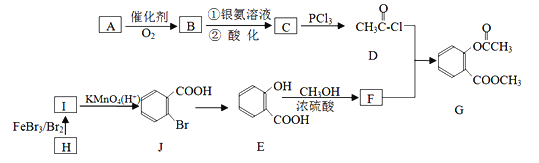
已知: B为醛类,C为一种常见的酸。
请回答以下问题:
(1)A的结构简式是__________。
(2)H→I的反应方程式_______________________,E→F的化学方程式是____________________。
(3)C→D的反应类型是_____________,I→J的反应类型是________________。
(4)两个E分子在一定条件下发生分子间脱水生成一种环状酯的结构简式是_____________。
(5)H的同系物中分子式为C9H12的同分异构体共有__________(填数字)种。其中核磁共振氢谱峰面积之比为6∶3∶2∶1的物质的结构简式为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com