
| A. | 加热 | |
| B. | 加入100 mL 0.1 mol•L-1的醋酸溶液 | |
| C. | 加入少量的0.5 mol•L-1的硫酸 | |
| D. | 加入少量的1 mol•L-1的NaOH溶液 |
分析 醋酸是弱电解质,弱电解质的电离是吸热反应,升高温度促进其电离,向醋酸中加入和氢离子反应或醋酸根离子反应的物质或者是加水稀释都能促进醋酸电离,但氢离子浓度减小,说明改变的条件能和氢离子反应.
解答 解:A.醋酸是弱电解质,醋酸的电离是吸热反应,升高温度促进醋酸电离,氢离子浓度增大,所以不符合条件,故A错误;
B.向溶液中加入相同浓度的醋酸溶液,氢离子浓度不变,所以不符合条件,故B错误;
C.向溶液中加入少量硫酸,氢离子浓度增大,抑制醋酸电离,所以不符合条件,故C错误;
D.向溶液中加入少量氢氧化钠溶液,氢氧根离子和氢离子反应,所以促进醋酸电离,且氢离子浓度降低,故D正确;
故选D.
点评 本题考查了弱电解质的电离,既要考虑促进醋酸电离又要考虑氢离子浓度降低,根据外界条件对其影响分析解答即可,难度不大.


 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:解答题
 实验室制备1,2-二溴乙烷的反应原理如下:C2H5OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O,CH2=CH2+Br2→CH2BrCH2Br,可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示.回答下列问题:
实验室制备1,2-二溴乙烷的反应原理如下:C2H5OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O,CH2=CH2+Br2→CH2BrCH2Br,可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示.回答下列问题:| 本题中出现有机物相关数据 | |||
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
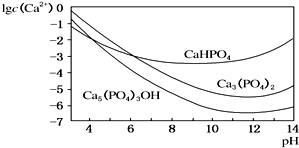 羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料,其常用的制备方法有两种:
羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料,其常用的制备方法有两种:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示.
(1)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉与氯化铁溶液混合:Fe+Fe3+=2Fe2+ | |
| B. | 氯化铝溶液与氨水反应:Al3++3OH-=Al(OH)3↓ | |
| C. | 碳酸钙与稀盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| D. | 醋酸与氢氧化钠溶液反应:CH3COOH+OH-=CH3COO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的盐酸和pH=1的盐酸,c(H+)之比为2:1 | |
| B. | NH4HSO4液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2 c(SO42-) | |
| C. | 已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;则三者关系为Ka•Kh=Kw | |
| D. | pH相等的四种溶液:a.CH3COONa;b.Na2CO3;c.NaHCO3;d.NaOH,其溶液物质的量浓度由小到大顺序为d、b、a、c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒).持续通入甲烷,在标准状况下,消耗甲烷的体积为V L.
将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒).持续通入甲烷,在标准状况下,消耗甲烷的体积为V L.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L | B. | 2L | C. | 3L | D. | 2.8 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com