
| A. | 碱性氧化物一定是金属氧化物,但酸性氧化物不一定都是非金属氧化物 | |
| B. | 胶体会产生电泳现象是因为胶体吸附带电离子而显电性 | |
| C. | 电解质与非电解质的本质区别是水溶液能否导电 | |
| D. | 离子反应是否能够发生要看离子之间能否发生复分解反应 |
分析 A、碱性氧化物一定是金属氧化物,酸性氧化物可以是金属氧化物;
B、胶体中的胶粒在外加电源的作用下会发生定向移动是由于胶体粒子具有较大的表面积,是胶体的电泳现象;
C、电解质是指在水溶液中或熔融状态下能导电的化合物,非电解质指的是在水溶液中和熔融状态下均不能导电的化合物;
D、发生离子反应的条件是发生复分解反应,氧化还原反应,络合反应等.
解答 解:A、碱性氧化物一定是金属氧化物,酸性氧化物可以是金属氧化物,如:Mn2O7是酸性氧化物,故A正确;
B、胶体粒子具有较大的表面积,能吸附阳离子或阴离子,所以胶体具有吸附性,胶体的胶粒吸附胶体中带电荷的离子带电,如氢氧化铁胶体的胶粒吸附三价铁离子,带正电荷,通电后,氢氧化铁胶体的胶粒向阴极移动,产生电泳现象,故B正确;
C、电解质是指在水溶液中或熔融状态下能导电的化合物,非电解质指的是在水溶液中和熔融状态下均不能导电的化合物,两者的本质区别是在水溶液中和熔融状态下本身能否电离出自由移动的离子而导电,与水溶液是否导电无必然联系,故C错误;
D、离子反应是否能够发生要看离子之间能否发生复分解反应,氧化还原反应,络合反应等,故D错误;
故选AB.
点评 本题考查了化学概念和物质分类的理解应用,主要是电解质、非电解质、胶体,氧化物的概念实质分析,掌握基础是关键,题目难度中等.


 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 4molA+2molB | B. | 2molA+1molB+2molC | ||
| C. | 2molC+1molB | D. | 1molA+0.5molB+1molC |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ②④ | B. | ②③④ | C. | ②④ | D. | ②④③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 活泼的金属粉尘遇明火均易引起爆炸 | |
| B. | 任何金属粉末在不正确操作下均可能引起爆炸 | |
| C. | 汽车轮毂表面镀铝既增加美观度,又耐腐蚀 | |
| D. | 事故告诫人们安全生产,防污、防爆非常重要 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
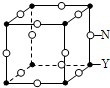 原子序数依次增大的X、Y、Z、M、N五种元素,XZ2是引起温室效应的主要气体,M最外层电子数是电子层数的2倍,N2+核外3d有9个电子,请回答下列问题:
原子序数依次增大的X、Y、Z、M、N五种元素,XZ2是引起温室效应的主要气体,M最外层电子数是电子层数的2倍,N2+核外3d有9个电子,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2S在反应中既是氧化剂又是还原剂 | |
| B. | 以上反应中转移电子的物质的量为1 mol | |
| C. | 以上参加反应的HNO3中被还原的HNO3为2 mol | |
| D. | 反应中,氧化剂和还原剂的物质的量之比为4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 滤液A中不含Fe3+ | |
| B. | 样品中含氧元素的物质的量为0.01mol | |
| C. | 上图中V=112 | |
| D. | 溶解样品的过程中消耗的硫酸的总的物质的量为0.02mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不用稀硫酸,改用98%浓硫酸 | B. | 加入更多锌片 | ||
| C. | 加入适量的氯化钠溶液 | D. | 加入数滴氯化铜溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com