
| A. | 在蒸馏水中滴加浓硫酸,Kw不变 | |
| B. | 在Na2S稀溶液中,c(H+)=c( OH-)-2c(H2S)-c(HS-) | |
| C. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度不相同 | |
| D. | 将pH=1的强酸溶液加水稀释后,溶液中各离子的浓度均减小 |
分析 A.浓硫酸溶解溶液温度升高,促进水的电离,离子积常数增大;
B.溶液中存在质子守恒,水电离出的氢离子浓度的所有存在形式总和和氢氧根离子浓度相同;
C.氯化钠是强酸强碱盐,对水的电离无影响,醋酸铵是弱酸弱碱盐水解相互促进,水解程度相近溶液显中性;
D.溶液中存在离子积常数,将pH=1的强酸溶液加水稀释后,溶液中氢离子的浓度减小,氢氧根离子浓度增大;
解答 解:A.浓硫酸溶解于水,溶液温度升高,水的电离是吸热过程,温度升高促进水的电离,离子积常数增大,故A错误;
B.溶液中存在质子守恒,水电离出的氢离子浓度的所有存在形式总和和氢氧根离子浓度相同,在Na2S稀溶液中,c( OH-)=2c(H2S)+c(HS-)+c(H+),c(H+)=c( OH-)-2c(H2S)-c(HS-),故B正确;
C.氯化钠是强酸强碱盐,对水的电离无影响,醋酸铵是弱酸弱碱盐水解相互促进,水解程度相近溶液显中性,溶液中水的电离程度不相同,故C正确;
D.溶液中存在离子积常数,将pH=1的强酸溶液加水稀释后,溶液中氢离子的浓度减小,氢氧根离子浓度增大,故D错误;
故选BC.
点评 本题考查了离子浓度大小比较,溶液中物料守恒、影响水的电离平衡、溶液中离子积常数的应用,题目难度中等.


科目:高中化学 来源: 题型:解答题
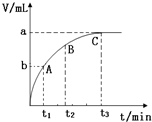 某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同的粉末状和块状的MnO2分别加入盛有15ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同的粉末状和块状的MnO2分别加入盛有15ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在地壳中,B元素的含量位于第二位 | |
| B. | C元素的单质熔点低,在空气中加热时先熔化后燃烧 | |
| C. | A、B、D三种元素形成的化合物一定是强酸 | |
| D. | B元素与A元素形成的物质一定是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂、纤维素、淀粉都是高分子化合物 | |
| B. | 煤的干馏、蛋白质的变性和纳米银粒子的聚焦都是化学变化 | |
| C. | 酒精、甲苯、四氯化碳都能萃取碘水中的碘单质 | |
| D. | 乙烯、乙炔都可作为合成聚合物的单体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
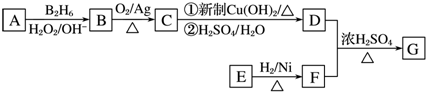
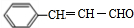 ;
;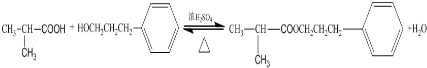 ;
;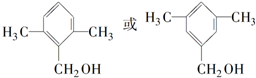 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
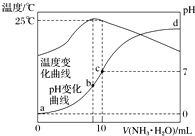 在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示.下列有关说法正确的是( )
在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示.下列有关说法正确的是( )| A. | n=1.0 | |
| B. | 水的电离程度:b>c>a>d | |
| C. | c点:c(NH${\;}_{4}^{+}$)=c(Cl-)=1.0 mol•L-1 | |
| D. | 25℃时,NH4Cl的水解常数(Kh)计算式为=$\frac{(\frac{n}{2}-0.5)×1{0}^{-7}}{0.5}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
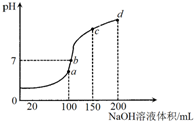 室温时,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示:对图中a、b、c、d四个点分析中,正确的是( )
室温时,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示:对图中a、b、c、d四个点分析中,正确的是( )| A. | a点水的电离程度最大 | B. | b点c(NH4+)=2c(SO42-) | ||
| C. | c点c(NH4+)+c(NH3•H2O)=c(Na+) | D. | d点c(NH4+)+c(Na+)=c(SO42-)+c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com