
 .
.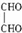 .
. .
.分析 (1)该有机物为烃类物质,然后利用商余法确定其分子式,最后确定其结构简式;
(2)分子中含有甲基且能够发生银镜反应,则其分子中含有醛基,再结合含有甲基利用商余法确定其结构简式;
(3)分子中的C、H、O都只有一种类型(化学环境相同),则至少含有1个C、H、O,式量为29,说明含有2个-CHO;
(4)不能使溴水褪色,但能与金属钠反应,则有机物含有羟基和环;核磁共振氢谱测得有3个吸收峰,其面积比为4:1:1,说明有3种氢原子;
(5)既能使溴水褪色,又能与金属钠反应,则有机物含有羟基和双键.
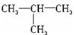
解答 解:(1)若若该有机物只由碳氢组成,则该有机物为烃,根据商余法:$\frac{58}{14}$=4…10,则其分子式为C4H10,为丁烷,丁烷的同分异构体有:正定烷CH3CH2CH2CH3或异丁烷 ,
,
故答案为:CH3CH2CH2CH3、 ;
;
(2)若其是含氧衍生物,分子中含有甲基且能够发生银镜反应,则该有机物分子中含有醛基,属于醛类物质,其分子中含-CH3、-CHO,剩余原子量为:58-15-29=14,$\frac{14}{12}$=1…2,则该有机物的结构简式为:CH3CH2CHO,
故答案为:CH3CH2CHO;
(3)分子中的C、H、O都只有一种类型(化学环境相同),则至少含有1个C、H、O,式量为29,说明含有2个-CHO,有机物的结构简式为: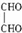 ,
,
故答案为: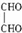 ;
;
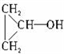
(4)不能使溴水褪色,但能与金属钠反应,则有机物含有羟基和环,核磁共振氢谱测得有3个吸收峰,其面积比为4:1:1,说明有3种氢原子,其结构简式为 ,
,
故答案为: ;
;
(5)既能使溴水褪色,又能与金属钠反应,则有机物含有羟基和双键,其结构简式为:CH2=CHCH2OH,
故答案为:CH2=CHCH2OH.
点评 本题考查了分子式的确定、有机物的推断、结构简式的书写等知识,题目难度中等,熟练掌握常见有机物结构与性质为解答关键,试题知识点较多、综合性较强,充分考查了学生的分析能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
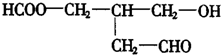 若使X通过化学变化,失去光学活性,可能发生的反应类型有( )
若使X通过化学变化,失去光学活性,可能发生的反应类型有( )| A. | ①②③④ | B. | ①②③④⑤ | C. | ③④⑤ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
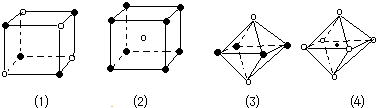
| A. | 图1和图3 | B. | 图2和图3 | C. | 图1 和图4 | D. | 只有 图1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HI>HBr>HCl>HF | B. | 沸点:HI>HBr>HCl>HF | ||
| C. | 还原性:HI>HBr>HCl>HF | D. | 热稳定:HF>HCl>HBr>HI |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
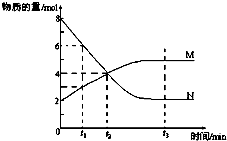 一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图,依图所示:
一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图,依图所示: M.
M.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水电离出的c(H+)=l×10-12mol/L的溶液中:K+、Ba2+、Cl-、NO3- | |
| B. | 无色溶液中可能大量存在:Al3+、NH4+、Cl-、S2- | |
| C. | pH=7的中性溶液中:Fe3+、K+、Cl-、SO42- | |
| D. | 酸性溶液中可能大量存在:Na+、ClO-、SO42-、CN- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 20℃ | 40℃ | 60℃ | 100℃ |
| 溶解度(s) | 5.0g | 8.7g | 14.8g | 40.2g |
| 金属阳离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ |
| pH | 3.0 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com