
【题目】化合物甲由四种元素组成。某化学研究小组按如图流程探究其组成:

已知丙和丁是相对分子质量相同的常见气体,其中丁是空气的主要成分之一。请回答下列问题:
(1)甲的化学式为____。
(2)甲发生爆炸反应的化学方程式为____。
(3)已知化合物甲中,有两种元素的化合价为最高正价,另两种元素的化合价为最低负价,则爆炸反应中被氧化的元素与还原产物的物质的量之比为____。
【答案】AgOCN 2AgOCN=2Ag+N2↑+2CO↑ 1:2
【解析】
已知丙和丁是相对分子质量相同的常见气体,其中丁是空气的主要成分之一,由此可知丁是氮气,丙是一氧化碳。根据流程图可知氮气的物质的量为0.01mol,一氧化碳的物质的量为n(CO)= ![]() ,由此可知甲中C、N、O的原子个数比为1:1:1,化合物由四种元素组成,已知化合物中有两种元素的化合价为最高正价,另两种元素的化合价为最低负价,撞击甲容易发生爆炸生成三种物质,则甲中应该有一种金属元素,设甲的化学式为R(CNO)x,R的相对原子质量为M,根据反应2R(CNO)x=2R+2xCO+xN2,有
,由此可知甲中C、N、O的原子个数比为1:1:1,化合物由四种元素组成,已知化合物中有两种元素的化合价为最高正价,另两种元素的化合价为最低负价,撞击甲容易发生爆炸生成三种物质,则甲中应该有一种金属元素,设甲的化学式为R(CNO)x,R的相对原子质量为M,根据反应2R(CNO)x=2R+2xCO+xN2,有![]() ,所以M=108x,设x=1,2,3,……,当x=1时,M=108,R为银元素,当x取2、3……时,没有对应的金属元素的相对原子质量符合要求,所以甲为AgOCN。
,所以M=108x,设x=1,2,3,……,当x=1时,M=108,R为银元素,当x取2、3……时,没有对应的金属元素的相对原子质量符合要求,所以甲为AgOCN。
(1)由分析可知,甲的化学式为AgOCN,故答案为:AgOCN;
(2)由分析可知,乙为银单质,丙为一氧化碳,丁为氮气,则甲发生爆炸反应的化学方程式为2AgOCN=2Ag+N2↑+2CO↑,故答案为:2AgOCN=2Ag+N2↑+2CO↑;
(3)根据爆炸反应方程式可知,爆炸反应中被氧化的元素为氮元素,共2mol,还原产物为银单质和一氧化碳,共4mol,则爆炸反应中被氧化的元素与还原产物的物质的量之比为1:2,故答案为:1:2。


科目:高中化学 来源: 题型:
【题目】利用有机物X在一定条件下可合成植物生长所需的“平衡因子”Y(部分产物未写出)。已知含有“手性碳原子”的分子可形成对映异构体。下列有关说法中正确的是( )
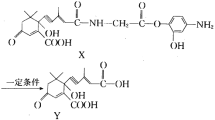
A.X,Y分子都不存在对映异构体
B.X分子中所有碳原子可能都在同一平面
C.Y分子可以发生取代、酯化、消去、加成、氧化等反应
D.未写出的产物可能有2种,且都具有两性化合物的特性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四个图象的说法中正确的是( )
A.①表示等质量的两份锌粉a和b,分别加入过量的稀硫酸中,a中同时加入少量CuSO4溶液,其产生的氢气总体积(V)与时间(t)的关系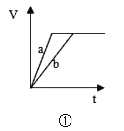
B.②表示合成氨反应中,每次只改变一个条件,得到的反应速率v与时间t的关系,则t3时改变的条件为增大反应容器的体积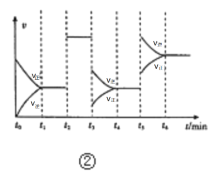
C.③表示其它条件不变时,反应4A(g)+3B(g)![]() 2C(g)+6D在不同压强下B%(B的体积百分含量)随时间的变化情况,则D一定是气体
2C(g)+6D在不同压强下B%(B的体积百分含量)随时间的变化情况,则D一定是气体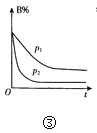
D.④表示恒温恒容条件下发生的可逆反应2NO2(g)![]() N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态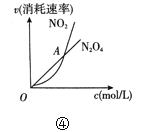
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率,请回答下列问题。
(1)①工业合成氨反应:N2+3H2![]() 2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1molN2完全反应生成NH3可放出92kJ热量。如果将10molN2和足量H2混合,使其充分反应,放出的热量___(填“大于”、“小于”或“等于”)920kJ。
2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1molN2完全反应生成NH3可放出92kJ热量。如果将10molN2和足量H2混合,使其充分反应,放出的热量___(填“大于”、“小于”或“等于”)920kJ。
②已知断开1molN![]() N键吸收的能量为945.6kJ,形成1molN﹣H键放出的能量为391kJ,根据化学方程式N2+3H2
N键吸收的能量为945.6kJ,形成1molN﹣H键放出的能量为391kJ,根据化学方程式N2+3H2![]() 2NH3,生成标准状况下44.8LNH3时放出的能量为92.4kJ,则断开1molH﹣H键吸收的能量是___。
2NH3,生成标准状况下44.8LNH3时放出的能量为92.4kJ,则断开1molH﹣H键吸收的能量是___。
(2)某实验小组同学进行如图1所示实验,以检验化学反应中的能量变化。请根据你掌握的反应原理判断,②中的温度___(填“升高”或“降低”)。反应过程___(填“①”或“②”)的能量变化可用图2表示。
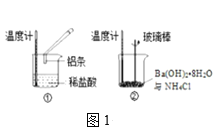
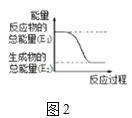
(3)已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图2所示,该反应是___(填“吸热”或“放热”)反应。
(4)用CH3OH和O2组合形成的质子交换膜燃料电池的结构如图3所示:

①则d电极是___(填“正极”或“负极”),c电极的电极反应式为___。
②若线路中转移2mol电子,则该燃料电池理论上消耗的O2在标准状况下的体积为___L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除尾气中的NO是环境科学研究的热点课题。
I.NO氧化机理
已知:2NO(g)+O2(g)![]() 2NO2(g) ΔH=-110kJmol-1
2NO2(g) ΔH=-110kJmol-1
T1℃时,将NO和O2按物质的量之比为2:1充入刚性反应容器中(忽略NO2与N2O4的转化)。
(1)下列可以作为反应已经到达平衡状态的判断依据的是____。
A.2v正(O2)=v逆(NO2)
B.NO与O2的物质的量之比为2:1
C.容器内混合气体的密度保持不变
D.K不变
E.容器内混合气体的颜色保持不变
(2)通过现代科学技术动态跟踪反应的进行情况,得到容器内混合气体的压强、平均摩尔质量随反应时间的变化曲线如图1图2所示。则反应2NO(g)+O2(g)![]() 2NO2(g)在T1℃时的平衡常数Kp=____。[对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=px(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数]。保持其它条件不变,仅改变反应温度为T2℃(T2>T1),在图2中画出容器内混合气体的平均摩尔质量随反应时间的变化趋势图_____。
2NO2(g)在T1℃时的平衡常数Kp=____。[对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=px(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数]。保持其它条件不变,仅改变反应温度为T2℃(T2>T1),在图2中画出容器内混合气体的平均摩尔质量随反应时间的变化趋势图_____。
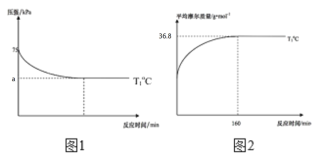
II.NO的工业处理
(3)H2还原法:2NO(g)+2H2(g)![]() N2(g)+2H2O(g) ΔH1
N2(g)+2H2O(g) ΔH1
已知在标准状况下,由元素最稳定的单质生成1mol纯化合物时的焓变叫做标准摩尔生成焓。NO(g)和H2O(g)的标准摩尔生成焓分别为+90kJmol-1、-280kJmol-1。则ΔH1=____。
(4)O3-CaSO3联合处理法
NO可以先经O3氧化,再用CaSO3水悬浮液吸收生成的NO2,转化为HNO2。已知难溶物在溶液中并非绝对不溶,同样存在着一定程度的沉淀溶解平衡。在CaSO3水悬浮液中加入Na2SO4溶液能提高SO32-对NO2的吸收速率,请用平衡移动原理解释其主要原因____。
(5)电化学处理法
工业上以多孔石墨为惰性电极,稀硝酸铵溶液为电解质溶液,将NO分别通入阴阳两极,通过电解可以得到浓的硝酸铵溶液。则电解时阳极发生的电极反应为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.碳元素广泛存在于自然界中,对人类生命和生活具有重要意义。含碳化合物在工业生产和国防建设中有广泛的应用。
(1)碳元素原子核外有_____个未成对电子,最外层有_____种能量不同的电子。CH4 分子的空间构型为_____,是_____分子。(填“极性”或“非极性”)
(2)碳和硅是同主族元素,下列能说明二者非金属性相对强弱的是_____(填编号)
a.CH4的稳定性比SiH4强 b.SiH4的沸点比CH4高
c.碳酸是强酸,硅酸是弱酸 d.碳原子半径比硅原子小
II.氮化硅(Si3N4)是一种重要的陶瓷材料,可用石英与焦炭在800℃氮气气氛下合成:3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)该反应的平衡常数表达式K_____。已知平衡常数:K(800℃)>K(850℃),则正反应是__________反应(填“放热”或“吸热”)
(2)任写两种能提高二氧化硅转化率的措施_____、_____。
(3)一定温度下,在2 L密闭容器内,充入一定量的反应物,5分钟时达到平衡,测得容器内气体增加了0.4mol,用CO表示该反应时间内的反应速率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 热化学方程式中,化学式前面的化学计量数既可表示微粒数,又可表示物质的量
B. 书写热化学方程式时,不仅要写明反应热的符号和数值,还要注明各物质的聚集状态
C. 热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据
D. 凡是化合反应都是放热反应,分解反应都是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁粉具有平肝镇心,消痈解毒之功效,主治惊痫、癫狂、脚气冲心、贫血等。某兴趣小组探究用氢气和碳酸亚铁制取铁粉并检验反应产物,实验装置如图。下列说法不正确的是
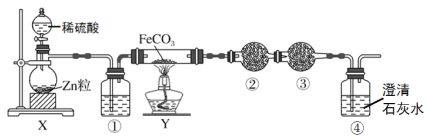
A.通过调节分液漏斗的活塞以控制①中气泡产生快慢
B.装置①的作用是干燥氢气
C.装置②、③中的药品分别是无水硫酸铜、碱石灰
D.加热装置Y前,应先让X反应一段时间,排除装置中的空气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com