
| A. | 0.1 mol/LNH4Cl溶液加水稀释后,溶液中各微粒的浓度均减小 | |
| B. | Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 | |
| C. | 稀硫酸和稀氢氧化钠溶液加热上升一定温度后,前者pH不变后者pH减小(不考虑物质的挥发) | |
| D. | pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等 |
分析 A.NH4Cl溶液显酸性,加水稀释氢离子浓度减小,氢氧根离子浓度增大;
B.Kw只与温度有关;
C.加热水的电离程度增大;
D.pH相同,则溶液中氢离子浓度相同.
解答 解:A.NH4Cl溶液显酸性,加水稀释氢离子浓度减小,由于氢离子浓度与氢氧根离子浓度的乘积不变,所以氢氧根离子浓度增大,故A错误;
B.Kw只与温度有关,Na2CO3溶液加水稀释后,溶液的浓度减小,恢复至原温度,pH减小,Kw不变,故B错误;
C.加热水的电离程度增大,稀硫酸中氢离子主要由酸电离,所以氢离子浓度不变,稀氢氧化钠中氢离子由水电离,则氢离子浓度增大,所以pH减小,故C正确;
D.pH相同,则溶液中氢离子浓度相同,所以pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)相等,故D错误.
故选C.
点评 本题考查了水的离子积、盐的水解原理,题目难度不大,注意把握影响水电离平衡的因素.


 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的氧化剂只有CuSO4 | |
| B. | SO42-既不是氧化产物也不是还原产物 | |
| C. | 1molCuSO4氧化了$\frac{1}{7}$mol的S | |
| D. | 被还原的S和被氧化的S的质量比为3:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用萃取分液的方法除去酒精中的水 | |
| B. | 将NH4Cl溶液蒸干制备NH4Cl固体 | |
| C. | 用可见光束照射以区别溶液和胶体 | |
| D. | 只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 水泥、玻璃、青花瓷、水晶、玛瑙、分子筛都属于硅酸盐工业产品 | |
| C. | 氨氮废水(含NH4+及NH3)可用化学氧化法或电化学氧化法处理 | |
| D. | 通入过量的空气,可以使燃料充分燃烧,同时提高热量的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中的阴离子肯定不存在金属元素 | |
| B. | 任何的阳离子只有氧化性,任何的阴离子只有还原性 | |
| C. | 与强酸、强碱都会反应的物质中只有两性氧化物或两性氢氧化物 | |
| D. | 根据化合物在水溶液中电离出的离子的类别,将化合物分为酸、碱、盐等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
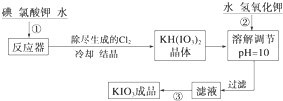
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3 g/100g H2O | 8.08 | 12.6 | 18.3 | 24.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com