
| 实验编号 | 金属材料 | 溶 液 | 实验目的 |
| ① | 铝合金 | CO2+H2O | Ⅰ.探究不同溶液对金属材料的腐蚀速率; Ⅱ.探究不同金属材料的腐蚀速率; |
| ② | |||
| ③ |
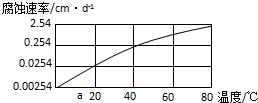
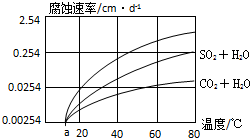 ,
,


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 6 |
| 19 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2S、Na2SO3、AgNO3、NaCl、NaOH |
| B、HCHO、CuSO4、NaOH、FeCl2、FeSO4 |
| C、Br2、CH3CHO、CH3COOH、Ag(NH3)2Cl、NaHCO3 |
| D、KAl(SO4)2、NaHSO4、Al2(SO4)3、KCl、MgCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com