
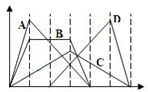
 图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量.下列选项编号对应的曲线编号错误的是( )
图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量.下列选项编号对应的曲线编号错误的是( )| A. | 向NaAlO2溶液中逐渐滴入HCl至过量 | |
| B. | 向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至过量 | |
| C. | 向澄清石灰水中通入CO2至过量 | |
| D. | 向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量 |
分析 A、根据反应AlO2-+H++H2O═Al(OH)3↓,Al(OH)3+3H+═Al3++3H2O判断;
B、根据反应2OH-+CO2═CO32-+H2O,Ca2++CO32-═CaCO3↓,CO32-+CO2+H2O═2HCO3-,CaCO3+CO2+H2O═Ca(HCO3)2判断
C、根据反应Ca(OH)2+CO2═CaCO3↓+H2O,CaCO3+CO2+H2O═Ca(HCO3)2判断;
D、根据反应Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O 判断.
解答 解:A、向NaAlO2溶液中滴入HCl至过量,发生的反应分别为AlO2-+H++H2O═Al(OH)3↓,Al(OH)3+3H+═Al3++3H2O,两个反应消耗的盐酸的物质的量之比为1:3,图象符合,故A正确;
B、向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至沉淀消失,发生的反应分别为2OH-+CO2═CO32-+H2O,Ca2++CO32-═CaCO3↓,CO32-+CO2+H2O═2HCO3-,CaCO3+CO2+H2O═Ca(HCO3)2,设Ca(OH)2的物质的量为xmol,则KOH也为xmol,所以各段反应消耗的二氧化碳的物质的量分别为x,x,x比值为1:1:1,故B错误
C、向澄清石灰水中通入CO2至过量,发生的反应分别为Ca(OH)2+CO2═CaCO3↓+H2O,CaCO3+CO2+H2O═Ca(HCO3)2,两个反应消耗的二氧化碳的物质的量之比为1;1,图象符合,故C正确;
D、向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量,发生的反应分别为OH-+H+═H20,Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,后两个反应消耗的NaOH的物质的量之比为3:1,图象符合,故D正确;
故选C.
点评 本题考查物质反应的图象题,题目难度中等,注意个反应的量的关系.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:多选题
| A. | 质量比为11:8 | B. | 原子个数之比为2:3 | ||
| C. | 物质的量之比为3:2 | D. | 密度之比为8:11 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火,可用泡沫灭火器扑灭 | |
| B. | 用10 mL量筒准确量取7.50 mL稀硫酸 | |
| C. | 用四氯化碳萃取溴水中的溴时,将溴的四氯化碳溶液从分液漏斗下口放出 | |
| D. | 在氢气还原氧化铜实验中,先加热氧化铜,后通入氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,8g甲烷中含C-H键的数目为4NA | |
| B. | 25℃时,1L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 1 mol冰醋酸和1mol乙醇经催化加热反应生成H2O的分子数为NA | |
| D. | 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据氧化物的性质可将氧化物分成酸性氧化物、碱性氧化物、两性氧化物和特殊氧化物等 | |
| B. | 根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应 | |
| C. | 根据分散质粒子直径大小可将液体分散系分为溶液、胶体和浊液 | |
| D. | 根据电解质的水溶液导电能力的强弱将电解质分为强电解质和弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于相同浓度的弱酸HX和HY(前者的Ka较小)溶液,加水稀释相同倍数时,HY溶液的pH改变值大于HX溶液的pH改变值 | |
| B. | 在NH3•H2O和NH4Cl浓度均为0.1 mol•L-1的体系中,外加少量酸或碱时,溶液的pH可保持基本不变 | |
| C. | 在NaH2PO4水溶液中存在关系:c(H3PO4)+c(H+)=c(HPO42-)+c(PO43-)+c(OH-) | |
| D. | 沉淀溶解平衡AgI?Ag++I- 的平衡常数为8.5×10-17,不能说明难溶盐AgI是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
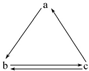 下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )| 选项 | a | b | c |
| A | S | SO2 | SO3 |
| B | HNO3 | NO | NO2 |
| C | Si | SiO2 | H2SiO3 |
| D | NH3 | NO2 | NO |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com