
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
方法a | 用炭粉在高温条件下还原CuO |
方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O |
方法c | 电解法,反应为2Cu+H2O |
方法d | 用肼(N2H4)还原新制的Cu(OH)2 |
(1)已知:①2Cu(s)+![]() O2(g)=Cu2O(s);△H=﹣169kJmol﹣1
O2(g)=Cu2O(s);△H=﹣169kJmol﹣1
②C(s)+![]() O2(g)=CO(g);△H=﹣110.5kJmol﹣1
O2(g)=CO(g);△H=﹣110.5kJmol﹣1
③Cu(s)+![]() O2(g)=CuO(s);△H=﹣157kJmol﹣1
O2(g)=CuO(s);△H=﹣157kJmol﹣1
则方法a发生的热化学方程式是:_____。
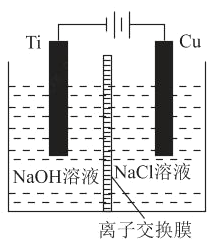
(2)方法c采用离子交换膜控制电解液中OH﹣的浓度而制备纳米Cu2O,装置如图所示:
该离子交换膜为_____离子交换膜(填“阴”或“阳”),该电池的阳极反应式为_____,钛极附近的pH值_____(填“增大”“减小”或“不变”)。
(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.该制法的化学方程式为_____。
(4)在相同的密闭容器中,用以上方法制得的三种Cu2O分别进行催化分解水的实验:
2H2O(g)![]() 2H2(g)+O2(g)△H>0.水蒸气的浓度随时间t变化如下表所示:
2H2(g)+O2(g)△H>0.水蒸气的浓度随时间t变化如下表所示:
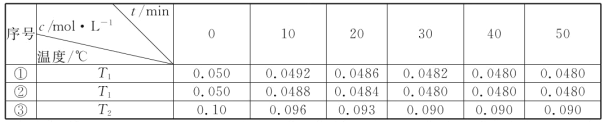
①对比实验的温度:T2_____T1(填“>”“<”或“=”),能否通过对比实验①③到达平衡所需时间长短判断:_____(填“能”或“否”)。
②实验①前20min的平均反应速率 v(O2)=_____
③催化剂的催化效率:实验①_____实验②(填“>”或“<”)。
【答案】C(s)+2CuO(s)=Cu2O(s)+CO(g)△H=+34.5kJmol﹣1 阴 2Cu﹣2e﹣+2OH﹣=Cu2O+H2O 增大 4Cu(OH)2+N2H4![]() 2Cu2O+N2↑+6H2O > 否 3.5×10﹣5mol/(Lmin) <
2Cu2O+N2↑+6H2O > 否 3.5×10﹣5mol/(Lmin) <
【解析】
(1) 已知:①2Cu(s)+![]() O2(g)=Cu2O(s);△H = -169kJ·mol-1,②C(s)+
O2(g)=Cu2O(s);△H = -169kJ·mol-1,②C(s)+![]() O2(g)=CO(g);△H = -110.5kJ·mol-1,③ Cu(s)+
O2(g)=CO(g);△H = -110.5kJ·mol-1,③ Cu(s)+![]() O2(g)=CuO(s);△H = -157kJ·mol-1,方法a是用碳在高温条件下还原氧化铜,方程式为:2CuO(s)+C(s)=Cu2O(s)+CO(g),由②-2×③-①×
O2(g)=CuO(s);△H = -157kJ·mol-1,方法a是用碳在高温条件下还原氧化铜,方程式为:2CuO(s)+C(s)=Cu2O(s)+CO(g),由②-2×③-①×![]() ,可以得到该方程式,根据盖斯定律,该反应的焓变为-110.5kJ·mol-1-2×(-157kJ·mol-1)-(-169kJ·mol-1)×
,可以得到该方程式,根据盖斯定律,该反应的焓变为-110.5kJ·mol-1-2×(-157kJ·mol-1)-(-169kJ·mol-1)×![]() =+34.5kJ/mol;
=+34.5kJ/mol;
(2)根据总反应可以写出阳极反应式,阳极反应式为:2Cu-2e-+2OH-=Cu2O+H2O,消耗氢氧根,pH减小,所以离子交换膜是阴离子交换膜,Ti极是阴极,阴极的电极反应式为2H2O+2e=H2↑+2OH,Ti极附近的pH增大,为答案为:阴;2Cu-2e-+2OH-= Cu2O+H2O;增大;
(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,结合元素守恒写出化学反应方程式为4Cu(OH)2+N2H4![]() 2Cu2O+6H2O+N2↑;
2Cu2O+6H2O+N2↑;
(4)实验①③或者②③相比,起始物质的量浓度③是①(或②)的2倍,达到平衡时③中物质的量浓度小于①(或②)的2倍,水蒸气的转化率降低,所以T2>T1,不可以通过比较达到平衡的时间来判断温度的大小,在这个实验里面,温度不是唯一影响速率的因素,还有催化剂,答案为:>;否;
②①前20 min的平均反应速率 v(O2)=![]() v(H2O)=
v(H2O)= ![]() =3.5×10-5 mol/(L·min);
=3.5×10-5 mol/(L·min);
③根据表中数据可知,实验①反应速率较快,催化剂的催化效率:实验①>实验②。


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源: 题型:
【题目】实验室用硼镁泥为原料制取MgSO4·7H2O粗产品的过程如下:
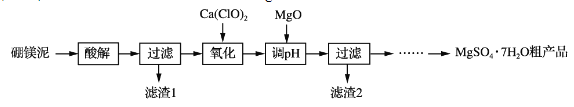
硼镁泥的主要成分如下表:
MgO | SiO2 | FeO、Fe2O3 | CaO | Al2O3 | B2O3 |
30%~40% | 20%~25% | 5%~15% | 2%~3% | 1%~2% | 1%~2% |
(1)“酸解”时为提高Mg2+的浸出率,可采用的措施是_____(写一种)。所加酸不宜过量太多的原因是_____。
(2)“氧化”步骤中,若用H2O2代替Ca(ClO)2,则发生反应的离子方程式为______________。实际未使用H2O2,除H2O2成本高外,还可能的原因是______________________________________。
(3)“调pH”时用MgO而不用NaOH溶液的原因是________________________。
(4)结合附表信息,由MgSO4·7H2O粗产品(含少量CaSO4)提纯获取MgSO4·7H2O的实验方案如下:将粗产品溶于水,_________________________________________________,室温下自然挥发干燥。(实验中必须使用的试剂有:饱和MgSO4溶液,乙醇)附:两种盐的溶解度(g/100 g水)
温度℃ | 10 | 30 | 40 | 50 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 |
MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)某实验小组利用如下装置(部分固定装置略)进行氮气与钙的反应,并探究其产物的性质及化学式。请回答下列问题。
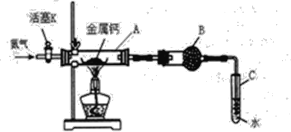
(1)反应过程中末端导管必须插入试管C的水中,目的是____。(填字母)
A.吸收反应中剩余的氮气
B.控制通入气体的流速
C.防止空气中的氧气倒流进入反应装置,干扰反应
(2)该小组同学认为根据相应的质量关系可以求出生成物的化学式,数据记录如下:
A的质量m0/g | A与钙的质量m1/g | A与产物的质量m2/g |
14.80 | 15.08 | 15.15 |
①通过计算得到化学式CaxN2,其中x=____。
②小组同学查阅资料得知产物为Ca3N2,能与水强烈反应,请写出Ca3N2与水反应的化学方程式_____。
(二)铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2![]() 6SO2+Fe3O4,若有3molFeS2参加反应,转移电子的物质的量为_____。
6SO2+Fe3O4,若有3molFeS2参加反应,转移电子的物质的量为_____。
(2)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为____。
(3)将一定量的Fe2O3溶于160mL 5molL-1盐酸中,再加入一定量铁粉,铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断裂1mol化学键吸收的能量或形成1mol化学键释放的能量称为键能,部分物质的键能如下表所示:
化学键 | C-H | C=O | N-H | C-N | H-O |
键能(kJ/mol) | a | b | c | d | e |
甲醛制备乌洛托品的反应如下,6![]() (g) + 4NH3(g) →
(g) + 4NH3(g) →  + 6H2O(l)
+ 6H2O(l)
该反应的⊿H为 ( )
A. 6(a+b+c-d-e)kJ/molB. 6(d+e-a-b-c)kJ/mol
C. 6(b+2c-2d-2e)kJ/molD. 6(2d+2a+2e-b-3c)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林(乙酰水杨酸,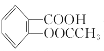 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
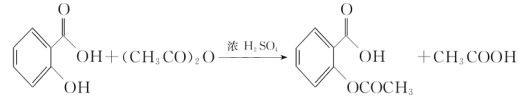
制备基本操作流程如下:
![]()
主要试剂和产品的物理常数如下表所示:
名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
水杨酸 | 138 | 158(熔点) | 微溶 |
醋酸酐 | 102 | 139.4(沸点) | 易水解 |
乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
请根据以上信息回答下列问题:
(1)制备阿司匹林时,要使用干燥的仪器的原因是_____.
(2)合成阿司匹林时,最合适的加热方法是_____.
(3)提纯粗产品流程如下,加热回流装置如图:
![]()
①使用温度计的目的是控制加热的温度,防止_____.
②冷凝水的流进方向是_____(填“a”或“b”);
③趁热过滤的原因是_____.
④下列说法正确的是_____(填选项字母).
a.此种提纯方法中乙酸乙酯的作用是做溶剂
b.此种提纯粗产品的方法叫重结晶
c.根据以上提纯过程可以得出阿司匹林在乙酸乙酯中的溶解度低温时大
d.可以用紫色石蕊溶液判断产品中是否含有未反应完的水杨酸

(4)在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(ρ=1.08g/cm3),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为_____(用百分数表示,小数点后一位).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种气态烷烃和一种气态烯烃组成的混合物共0.1 mol,完全燃烧得0.16 mol二氧化碳和3.6 g水。下列说法正确的是( )
A. 一定有甲烷 B. 一定是甲烷和乙烯 C. 可能有乙烷 D. 一定有乙炔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯在催化剂的作用下可发生氧化反应,其反应机理为:PdCl2+C2H4+H2O![]() Pd+2HCl+CH3CHO,Pd+2CuCl2 PdCl2+2CuCl,4CuCl+4HCl+O2 4CuCl2+2H2O,下列说法错误的是
Pd+2HCl+CH3CHO,Pd+2CuCl2 PdCl2+2CuCl,4CuCl+4HCl+O2 4CuCl2+2H2O,下列说法错误的是
A. 催化剂加快反应速率的原理是通过改变反应路径降低了活化能
B. 该催化氧化反应的总方程式是2C2H4+O2![]() 2CH3CHO
2CH3CHO
C. 该催化氧化过程可在无水条件下进行
D. CuCl2和PdCl2的混合溶液可作为该反应的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为配制480mL0.1mol·L-1Na2SO4溶液。回答下列问题。
(1)配制Na2SO4溶液时需用的主要仪器有托盘天平、药匙、烧杯、玻璃棒、___、___。
(2)用托盘天平称十水硫酸钠(Na2SO4·10H2O)晶体__g。
(3)下列操作对所配溶液的浓度有何影响(填“偏高、偏低或无影响”)
A.误用“左码右物”的称量方法称该晶体___
B.容量瓶未经干燥即使用___
C.溶解后没有冷却便进行定容___
D.忘记将洗涤液转入容量瓶___
E.定容时俯视刻度线定容___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应中反应物与生成物有:FeCl2、FeCl3、CuCl2、Cu。

(1)将上述反应设计成的原电池如图甲所示,请回答下列问题:
①图中X溶液是 ;②Cu电极上发生的电极反应式为 ;
③原电池工作时,盐桥中的 离子(填“K+”或“Cl—”)不断进入X溶液中。
(2)将上述反应设计成的电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量的变化关系如图丙,请回答下列问题:
①M是 极;②图丙中的②线是 离子的变化。
③当电子转移为2mol时,向乙烧杯中加入 L 5mol·L-1NaOH溶液才能使所有的金属阳离子沉淀完全。
(3)铁的重要化合物高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂,具有很多优点。
①高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O![]() Na2FeO4+3H2↑,则电解时阳极的电极反应式是 。
Na2FeO4+3H2↑,则电解时阳极的电极反应式是 。
②高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为 。
③Na2FeO4能消毒、净水的原因 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com