
| A. | 盐酸和氢氧化铜 | B. | 硫酸和氢氧化钠溶液 | ||
| C. | 醋酸和氢氧化钡溶液 | D. | 稀硝酸和氨水混合 |
分析 离子方程式H++OH-═H2O表示强酸和强碱发生中和反应生成可溶性盐和水的一类反应,酸必须为强酸,如稀盐酸、硝酸等,碱必须是可溶性强碱,如氢氧化钠、氢氧化钾等,据此进行解答.
解答 解:A.氢氧化铜不能拆开,则盐酸与氢氧化铜反应离子方程式为:Cu(OH)2+2H+=2H2O+Cu2+,不能用离子方程式H++OH-=H2O表示,故A错误;
B.硫酸和氢氧化钠溶液反应的离子方程式:H++OH-=H2O,故B正确;
C.醋酸为弱酸,不能拆开,醋酸与氢氧化钡溶液反应离子方程式:CH3COOH+H+=CH3COO-+H2O,不能用离子方程式H++OH-=H2O表示,故C错误;
D.在离子反应中弱碱一水合氨不能拆开,则稀硝酸和氨水混合反应的离子方程式:H++NH3•H2O=H2O+NH4+,不能用离子方程式H++OH-=H2O表示,故D错误;
故选B.
点评 本题考查了离子方程式的书写,题目难度不大,明确离子反应的书写方法、反应的实质是解题关键,注意掌握离子方程式表示的意义,试题侧重基础知识的考查,有利于提高学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:实验题
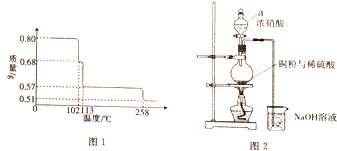 硫酸在古代被称为“绿矾油”,唐代炼丹家孤刚子在其所著《黄帝九鼎神丹经诀》中记有“炼石胆取精华法”即通过锻烧胆矾而获得硫酸的方法.请回答下列问题:
硫酸在古代被称为“绿矾油”,唐代炼丹家孤刚子在其所著《黄帝九鼎神丹经诀》中记有“炼石胆取精华法”即通过锻烧胆矾而获得硫酸的方法.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.1mol•L-1CH3COOH溶液中加入少量水,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$减小 | |
| B. | 将CH3COONa溶液从20℃升温至30℃,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$增大 | |
| C. | 向盐酸中加入氨水至中性,溶液中$\frac{c(N{H}_{4}^{+})}{c(C{l}^{-})}$>1 | |
| D. | 0.1mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合:$\frac{2}{3}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在原电池的负极和电解池的阴极上都是发生失电子的氧化反应 | |
| B. | 用惰性电极精炼铜时,电解质溶液没有变化 | |
| C. | 用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH | |
| D. | 镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com