
| A. | 此混合气体中可能含有乙烷 | |
| B. | 此气体中一定含有甲烷 | |
| C. | 此混合气体中一定不含有丙烷 | |
| D. | 此气体若是乙烯与甲烷的混合气体,则甲烷与乙烯的体积比为2:3 |
分析 标况下,2.24L两种气态烃组成的混合物,其物质的量为0.1mol,完全燃烧得到0.16mol二氧化碳和3.6g水,水的物质的量为0.2mol,则混合气体平均分子式为C1.6H4,肯定含有C原子数小于1.6的烃,即一定含有甲烷,因甲烷中含有4个氢原子,则另一种烃也含有4个氢原子.
解答 解:标况下,2.24L两种气态烃组成的混合物,其物质的量为0.1mol,完全燃烧得到0.16mol二氧化碳和3.6g水,水的物质的量为0.2mol,则混合气体平均分子式为C1.6H4,肯定含有C原子数小于1.6的烃,即一定含有甲烷,因甲烷中含有4个氢原子,则另一种烃也含有4个氢原子,不能为乙烷、丙烷,可能为乙烯、丙炔等,若为乙烯与甲烷,令其物质的量分别为xmol、ymol,根据平均C原子数,则:$\frac{2x+y}{x+y}$=1.6,整理得x:y=3:2,即甲烷与乙烯的物质的量为2:3,相同条件下,物质的量之比等于其体积之比,由上述分析可知,A错误,BCD正确,
故选A.
点评 本题考查混合物计算、有机物分子式确定等,难度不大,关键是利用平均分子组成判断烃的组成,常用方法有:1、平均碳法 2、平均氢法 3、平均碳氢分子式法 4、平均式量法.


科目:高中化学 来源: 题型:解答题
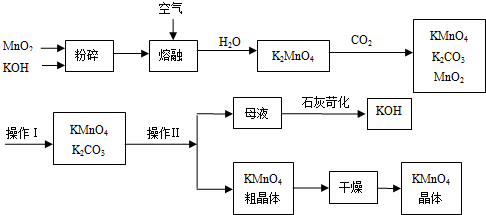
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | |
| B. | CH2=CH2+HBr→CH3CH2Br | |
| C. | 2CH3CH2OH+2Na→2 CH3CH2ONa+H2↑ | |
| D. | 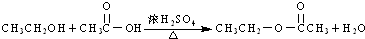 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2、H2和NH3三者共存 | |
| B. | 容器内气体的密度不再发生变化 | |
| C. | N2、H2和NH3的物质的量浓度相等 | |
| D. | 单位时间消耗0.1 mol N2的同时生成0.2 mol NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
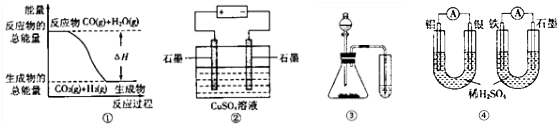
| A. | 图①表示可逆反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0 | |
| B. | 图②为电解硫酸铜溶液的装置,一段时间后,阴、阳两极有可能收集到相同体积的气体 | |
| C. | 图③实验装置可完成比较乙酸、碳酸、苯酚酸性强弱的试验 | |
| D. | 图④两个装置中个,通过导线的电子数相同时,消耗负极材料的物质的量也相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
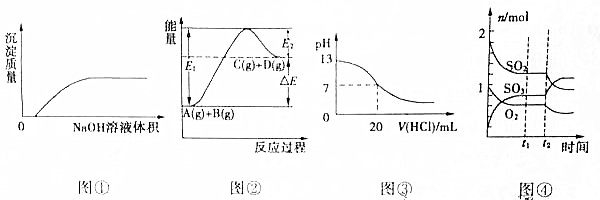
| A. | 图①表示将NaOH溶液滴入Ba(HCO3)2溶液中 | |
| B. | 图②表示反应物的总键能小于生成物的总键能 | |
| C. | 图③表示25℃时,0.1mol/L盐酸滴入20mL0.1mol/LNaOH溶液中,溶液的pH随加入酸体积的变化曲线 | |
| D. | 图④表示一定条件下的反应2SO2(g)+O2?2SO3(g)△H<0,t2时刻改变的曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | |
| B |
| A. | 铍能与冷水发生剧烈反应 | |
| B. | 氢氧化铍既能与强酸溶液反应,又能与强碱溶液反应 | |
| C. | 氢氧化铍的化学式为Be(OH)3 | |
| D. | 氧化铍只溶于强酸溶液,不溶于强碱溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 颗粒状的单质锶与稀硫酸反应,反应现象不如钠和水反应剧烈 | |
| B. | 锶在纯净氮气中可以燃烧,燃烧产物投入水中可以放出气体 | |
| C. | 锶在纯氧中点燃可燃烧,燃烧生产的产物投入水中可以放出气体 | |
| D. | 颗粒状的单质锶投入水中,剧烈反应,生成大量的气体并引起气体燃烧和轻微爆炸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com