
| A. | 使用大量水 | B. | 使用泡沫式灭火器 | ||
| C. | 使用黄沙 | D. | 使用干粉(NaHCO3) |
分析 A.电石和过氧化物能和水反应生成易燃物质、或助燃物质;
B.泡沫式灭火器原理为NaHCO3与Al2(SO4)3发生相互促进的水解反应生成二氧化碳和氢氧化铝,二氧化碳和过氧化物反应生成助燃物质氧气;
C.灭火的原理:①清除可燃物或使可燃物与其他物品隔离;②隔绝氧气或空气;③使温度降到可燃物的着火点以下;破坏燃烧的一个条件使燃烧停止,就可以达到灭火的目的;
D.使用干粉(NaHCO3)受热分解生成二氧化碳、水,能和电石和过氧化物反应生成易燃物质、或助燃物质.
解答 解:A.电石和水反应生成乙炔,乙炔为易燃物质,过氧化物和水反应生成氧气,为助燃物质,所以不能使用大量水灭火,故A错误;
B.泡沫式灭火器中NaHCO3与Al2(SO4)3发生相互促进的水解反应,离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑,二氧化碳和过氧化物反应生成助燃物质氧气,故B错误;
C.使用黄沙,隔绝空气,能到达灭火的目的,故C正确;
D.NaHCO3不稳定,加热分解生成碳酸钠、水和二氧化碳气体,反应的方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,二氧化碳和过氧化物反应生成助燃物质氧气,过氧化物和水反应生成氧气,故D错误;
故选C.
点评 本题考查灭火的方法,注意根据具体物质的性质来确定用什么方法进行灭火,题目难度不大.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
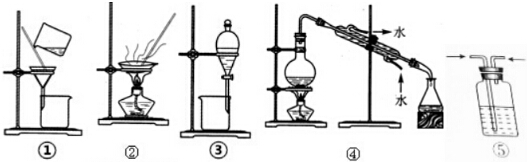
| A. | 装置①和②可进行粗盐提纯实验 | |
| B. | 装置③可进行分离Na2CO3溶液和CH3COOC2H5的实验 | |
| C. | 装置④可进行利用自来水制取少量蒸馏水的实验 | |
| D. | 装置⑤可进行用浓硫酸干燥氯气的实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 向100mlMgCl2 和 AlCl3的混合溶液,逐滴加入1mol/LNaOH溶液,如图:
向100mlMgCl2 和 AlCl3的混合溶液,逐滴加入1mol/LNaOH溶液,如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
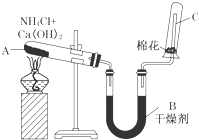 实验室中用如图所示装置制取干燥的氨气.
实验室中用如图所示装置制取干燥的氨气.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据HA、HB的电离常数的相对大小可以直接判断两种溶液的酸性强弱 | |
| B. | 常温下2S2O(g)=3S(s)+SO2(g)能自发进行,可推断该反应为放热反应 | |
| C. | 加入硫酸铜可使锌与稀硫酸的反应速率加快,说明Cu2+具有催化作用 | |
| D. | 将浓硫酸和浓硝酸混合后立即放入铁片,铁片被钝化的效果一定会更好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com