
| A. | 制备乙酸乙酯时可用热的NaOH代替饱和NaHCO3溶液来除去其中的乙酸 | |
| B. | SO2使酸性KMnO4溶液褪色与乙烯使溴水褪色的原理相同 | |
| C. | 可用CuSO4溶液除去制乙炔时混有的杂质H2S | |
| D. | 在AgI饱和溶液中加入KCl固体可产生白色沉淀,说明Ksp(AgCl)<Ksp(AgI) |
分析 A.乙酸乙酯在碱性条件下发生水解;
B.二氧化硫与高锰酸钾发生氧化还原反应,乙烯与溴水发生加成反应;
C.CuSO4可与H2S反应生成CuS沉淀;
D.如生成沉淀,应满足c(Ag+)×c(Cl-)>Ksp.
解答 解:A.乙酸乙酯在氢氧化钠溶液中发生水解,应用饱和碳酸钠溶液,故A错误;
B.二氧化硫与高锰酸钾发生氧化还原反应,乙烯与溴水发生加成反应,二者反应的原理不同,故B错误;
C.CuSO4可与H2S反应生成CuS沉淀,可用于除杂,故C正确;
D.在AgI饱和溶液中加入KCl固体可产生白色沉淀,说明c(Ag+)×c(Cl-)>Ksp,不能说明Ksp(AgCl)<Ksp(AgI),故D错误.
故选C.
点评 本题考查较为综合,涉及物质的分离、二氧化硫和乙烯的性质、难溶电解质的溶解平衡等问题,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意相关基础知识的积累,难度中等.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:选择题
| A. | H2SO4是氧化剂 | B. | NaClO3被氧化 | C. | ClO2是氧化产物 | D. | Na2SO3是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
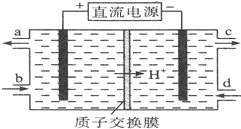 亚硝酸(HN02)在工业上用于有机合成,既具有氧化性又具有还原性,而且氧化性比还原性突出得多.回答下列问题:
亚硝酸(HN02)在工业上用于有机合成,既具有氧化性又具有还原性,而且氧化性比还原性突出得多.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的比例模型: | |
| B. | 次氯酸的结构式:H-Cl-O | |
| C. | 乙烯的结构简式为:CH2CH2 | |
| D. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
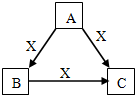 A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如右图.请针对以下三种情况不同情况回答:
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如右图.请针对以下三种情况不同情况回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O | |
| B. | 硝酸银溶液中滴加过量氨水:Ag++NH3•H2O═AgOH↓+NH${\;}_{4}^{+}$ | |
| C. | 将NaHSO4与Ba(OH)2溶液混合至中性:H++SO42-+Ba2++2OH-═BaSO4↓+H2O | |
| D. | 向氨水通入足量SO2:SO2+2NH3•H2O=2NH4++SO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 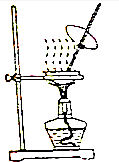 可用来蒸发FeCl3 溶液获得纯FeCl3 固体 | |
| B. |  可用向上排空气法收集CO2、NO 等气体 | |
| C. | 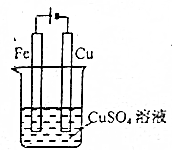 可以实现在铁棒上镀上一层铜 | |
| D. | 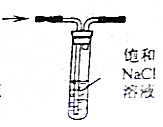 可以除去Cl2中混有的HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 2:11 | D. | 4:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com