
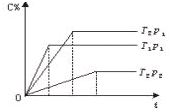
 可逆反应:2A(g)+B(g)?2C(g)在温度分别为T1、T2,压强分别为p1、p2条件下测得C的体积分数与时间t的关系如图所示,下列判断正确的是:
可逆反应:2A(g)+B(g)?2C(g)在温度分别为T1、T2,压强分别为p1、p2条件下测得C的体积分数与时间t的关系如图所示,下列判断正确的是:| A、p2<p1,逆反应放热 |
| B、p2>p1,正反应放热 |
| C、p2>p1,正反应吸热 |
| D、p2<p1,逆反应吸热 |


科目:高中化学 来源: 题型:
| A、甲酸能与水以任意比互溶 |
| B、1mol/L甲酸溶液的pH值约为2 |
| C、10ml 1mol/L甲酸恰好与10ml?1mol/L NaOH溶液完全反应 |
| D、HCOONa溶液的pH值大于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol/L NaHCO3和0.1 mol/L Na2CO3混合溶液1L,HCO3-,CO32-的总数为0.2NA |
| B、向密闭容器中充入2molN2和3molH2,在一定条件下发生反应,达到平衡时,混合气体中NH3的体积分数为23.45%,则H2和NH3所含的H原子总数为6NA |
| C、若1L0.1 mol/L的CH3COOH溶液含CH3COO- 数为aNA,则1L0.3 mol/L的CH3COOH溶液含CH3COO- 数小于0.3aNA |
| D、反应N2+3H2?2NH3达平衡时,每形成6NA个N-H键,也生成14克N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、用①装置制取干燥的氨气 |
| B、用②装置除去淀粉溶液中的NaCl |
| C、③装置可用于氨气的收集、检验 |
| D、④装置可用排空气法收集氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钡和硫酸钡均可用于钡餐透视 |
| B、为防止食物变质,可加入适量的食品添加剂 |
| C、浸泡过高锰酸钾溶液的硅藻土放于新鲜的水果箱内是为了催熟水果 |
| D、海水淡化可以解决淡水危机,向海水中加入明矾可以使海水淡化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡时甲、乙两容器体积相等 |
| B、平衡时甲、乙两容器中c(H2)相等 |
| C、平衡时甲、乙两容器中反应速率v(H2)相等 |
| D、平衡时甲、乙两容器中气体总的物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com