
周期元素W、X、Y、Z在周期表中的位置如图,其中Y所处的周期数与族序数相等。W最外层电子数是其内层电子数的3倍。下列说法不正确的是
|
|
| … | W |
X |
| Y | … | Z |
A.X、Y、Z、W的原子半径依次减小
B.气态氢化物的稳定性:W>Z
C.W与X形成的化合物中只含有离子键
D.W与Y形成的化合物可分别与NaOH溶液和盐酸反应
科目:高中化学 来源:2016-2017学年甘肃静宁一中高一上月考二化学试卷(解析版) 题型:选择题
在反应3NO2+H2O===2HNO3+NO中,发生还原反应和发生氧化反应的物质质量之比为
A.3∶1
B.1∶3
C.1∶2
D.2∶1
查看答案和解析>>
科目:高中化学 来源:2017届江苏省、六合等七校高三上期中化学试卷(解析版) 题型:实验题
焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中,受热时均易分解。实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如下图所示。

当溶液pH约为4时,停止反应。在20℃静置结晶,生成Na2S2O5的化学方程式为2NaHSO3=2Na2S2O5+H2O。
(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其离子方程式为 。
(2)装置Y的作用是 。
(3)析出固体的反应液经减压抽滤,洗涤,25℃-30℃干燥,可获得Na2S2O5固体。
①组成减压抽滤装置的主要仪器是布氏漏斗、 和抽气泵。
②依次用饱和SO2水溶液、无水乙醇洗涤Na2S2O5固体,用饱和SO2水溶液洗涤的目的是 。
(4)实验制得的Na2S2O5固体中含有一定量的Na2SO3 和Na2SO4,其可能的原因是 。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省、六合等七校高三上期中化学试卷(解析版) 题型:选择题
下列指定反应的离子方程式正确的是( )
A.将铜丝插入稀硝酸中:Cu+4H++2NO3-=Cu2++2NO2↑+H2O
B.向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe=2Fe2+
C.向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-
D.用氨水吸收足量的SO2气体:2OH-+SO2=SO32-+H2O
查看答案和解析>>
科目:高中化学 来源:2017届广东省韶关市六校高三上10月联考化学试卷(解析版) 题型:填空题
[化学——选修2:化学与技术]
研究人员研制利用低品位软锰矿浆(主要成分是MnO2)吸收硫酸厂的尾气SO2,制备硫酸锰的生产流程如下:
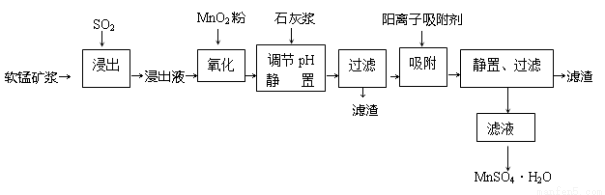
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。PbO2的氧化性大于MnO2。
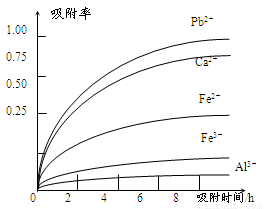
有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图
离子 | 离子半径 (pm) | 开始沉淀时 的pH | 完全沉淀时 的pH |
Fe2+ | 74 | 7.6 | 9.7 |
Fe3+ | 64 | 2.7 | 3.7 |
Al3+ | 50 | 3.8 | 4.7 |
Mn2+ | 80 | 8.3 | 9.8 |
Pb2+ | 121 | 8.0 | 8.8 |
Ca2+ | 99 | - | - |
(1)浸出过程中生成Mn2+反应的化学方程式为___________________________,
(2)Fe2+被氧化的过程中主要反应的离子方程式_________________________。
(3)在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至_______________范围。
(4)阳离子吸附剂可用于除去杂质金属离子。请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有______________________等(写二点)。
(5)吸附步骤除去的主要离子为___________________________。
(6)电解MnSO4 、ZnSO4和H4SO4的混合溶液可制备MnO2和Zn,写出阳极的电极反应方程式_______________。
查看答案和解析>>
科目:高中化学 来源:2017届广东省韶关市六校高三上10月联考化学试卷(解析版) 题型:选择题
生活中处处有化学,下列有关说法正确的是
A.饮用矿泉水瓶的主要成分是聚氯乙烯
B.淀粉和纤维素均为天然高分子化合物
C.凡含有食品添加剂的食物均不可食用
D.大米煮成粥后,淀粉就变成了葡萄糖
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北正定中学高一上第一次月考化学试卷(解析版) 题型:选择题
下列说法中正确的是、
A.在一定温度和压强下,各种气态物质体积大小由构成气体分子大小决定
B.在一定温度和压强下,各种气态物质体积的大小由构成气体的分子数决定
C.不同的气体,若体积不同,则它们所含的分子数—定不同
D.气体摩尔体积是指1mol任何气体所占的体积约为22.4L
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三10月月考化学试卷(解析版) 题型:选择题
含1 mol HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物与铁粉物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断正确的是
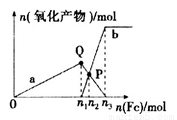
A.曲线a表示Fe2+,曲线b表示Fe3+
B.P点时总反应的离子方程式可表示为5Fe+16H++NO3-=3Fe2++2Fe3++4NO↑+8H2O
C.n2=0.25
D.n3:n1=3:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com