
【题目】化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成1 mol AX5,放出热量123.8 kJ。该反应的热化学方程式为_____________________________。
(2)反应AX3(g)+X2(g)![]() AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
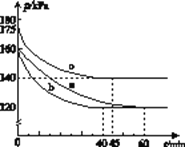
①列式计算实验a从反应开始至达到平衡时的反应速率v(AX5)=______________________。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为____________(填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b__________________,c_______________________________。
③用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为______________;实验a和c的平衡转化率:αa为________,αc为________。
【答案】 .AX3(l)+X2(g)===AX5(s) ΔH=-123.8 kJ/mol ![]() =1.7×10-4 mol·L-1·min-1 bca 加入催化剂。反应速率加快,但平衡点没有改变 温度升高。反应速率加快,但平衡点向逆反应方向移动(或反应容器的容积和起始物质的量未改变,但起始总压强增大) α=2(1-
=1.7×10-4 mol·L-1·min-1 bca 加入催化剂。反应速率加快,但平衡点没有改变 温度升高。反应速率加快,但平衡点向逆反应方向移动(或反应容器的容积和起始物质的量未改变,但起始总压强增大) α=2(1-![]() ) 50% 40%
) 50% 40%
【解析】试题分析:⑴据题意,先写出反应方程式并标出各物质的状态AX3(l)+X2(g) = AX5(s),然后确定其反应热ΔH=-123.8KJ·mol-1,综上便可写出完整的热化学方程式。
⑵①
解:开始时no=" 0.4" mol,总压强为160 kPa,平衡时总压强为120 kPa,
则n为:![]()
AX3(g) + X2(g)![]() AX5(g)
AX5(g)
起始时no/mol: 0.20 0.20 0
平衡时n/mol:: 0.20 -x 0.20 -x x
(0.20-x)+(0.20-x)+x = 0.30
x = 0.10
![]()
②从图中观察平衡的时间(tb<tc<ta),判断反应速率的快慢为b>c>a;
b组的反应速率加快,但平衡点没有改变说明是加人了催化剂;
c组的反应速率加快,但平衡点向逆反应方向移动(或反应容器的容积和起始物质的量未改变,但起始总压强增大)说明是温度升高。
③用三段式分析:
AX3(g) + X2(g)![]() AX5(g)
AX5(g)
起始时no/mol: 0.20 0.20 0
变化量n/mol:: 0.20α 0.20α 0.20α
平衡时n/mol:: 0.20 -0.20α 0.20 -0.20α 0.20α
据题意有![]() ,化简得α=2(1-
,化简得α=2(1-![]() );
);
将图中p0、p的数据代入上述计算式得αa=2(1-![]() )=2(1-
)=2(1-![]() )=50%;
)=50%;
αc=2(1-![]() )=2(1-
)=2(1-![]() )=40%。
)=40%。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D都是中学化学中的常见物质,其中A、B、C均含有同一种元素,A是一种强碱,C为厨房中的用品,在—定条件下相互转化关系如图(部分反应中的水己略去)。下列有关B、C的说法正确的是

A. 可以用BaCl2或CaCl2稀溶液或Ba(OH)2稀溶液鉴别B、C两种溶液
B. 分别取等质量的B、C两种固体与等体积等浓度盐酸反应,产生气体的速率一样
C. 取agB、C的混合物充分加热,固体质量减重bg,由此可计算出混合物中B的质量分数
D. 取a gB、C的混合物与足量稀硫酸充分反应,逸出的气体碱石灰完全吸收,增重bg,由此可计算出混合物中B的质量分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
A. 催化剂V2O5不改变该反应的逆反应速率
B. 恒压,通入稀有气体,反应速率不变
C. 该反应是放热反应,降低温度将缩短反应达到平衡的时间
D. 在t1、t2时刻,SO3(g)的浓度分别是cl、c2,则时间间隔t1t2内,SO2(g)消耗的平均速率为 v=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度C(X)随时间t变化的曲线如图所示,下列叙述正确的是( )
Y(g),温度T1、T2下X的物质的量浓度C(X)随时间t变化的曲线如图所示,下列叙述正确的是( )
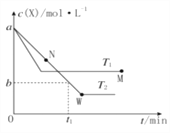
A. 该反应进行到M点放出的热量大于进行到W点放出的热量
B. T2 下,在 0t1时间内,v(Y)= ![]() mol·L-1·min-1
mol·L-1·min-1
C. M点的正反应速率v 正大于N点的逆反应速率v逆
D. M点时再加入一定量X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠用于原子反应堆的导热剂,也用于冶炼某些金属。下列说法正确的是 ( )
A. 钠非常活泼,通常保存在水中 B. 钠离子具有强还原性
C. 钠与酒精剧烈反应,浮在酒精上,熔化成小球 D. 钠具有强还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Fe2O3(s)+![]() C(s)=
C(s)=![]() CO2(g)+2Fe(s)△H=+234.1kJmol﹣1
CO2(g)+2Fe(s)△H=+234.1kJmol﹣1
C(s)+O2(g)=CO2(g)△H=﹣393.5kJmol﹣1
则2Fe(s)+![]() O2(g)=Fe2O3(s)的△H是( )
O2(g)=Fe2O3(s)的△H是( )
A. ﹣824.4kJmol﹣ B. ﹣627.6kJmol﹣1 C. +744.7kJmol﹣1 D. ﹣169.4kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据表中信息判断,下列选项正确的是 ( )
序号 | 反应物 | 产物 |
① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
② | Cl2、FeBr2 | FeCl3、FeBr3 |
③ | MnO | Cl2、Mn2+… |
A. 第①组反应的其余产物只有O2
B. 第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C. 第③组反应中生成1 mol Cl2,转移电子10 mol
D. 氧化性由强到弱顺序为MnO![]() >Cl2>Fe3+>Br2
>Cl2>Fe3+>Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g) ![]() 2SO3(g)是制备硫酸的重要反应.下列叙述正确的是( )
2SO3(g)是制备硫酸的重要反应.下列叙述正确的是( )
A.催化剂V2O5不改变该反应的逆反应速率
B.增大压强,反应速率一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,SO3(g)的浓度分别是c1、c2(c1<c2),则时间间隔为 t1~t2内(t1<t2 , 以秒为单位),SO3(g)生成的平均速率为v= ![]() ? mol?L﹣1?s﹣1
? mol?L﹣1?s﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃,反应N2O4![]() 2NO2 △H>0在密闭容器中达平衡,下列说法不正确的
2NO2 △H>0在密闭容器中达平衡,下列说法不正确的
A. 体积不变时加入少许NO2,再度平衡时颜色变深
B. 体积不变时加入少许N2O4,平衡正向移动,N2O4转化率减小
C. 容器体积减小时,平衡逆向移动,正反应速率减小,逆反应速率增大
D. 体积不变时升高温度,再度平衡时颜色变深
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com