
【题目】乙烯是重要化工原料,其产量是一个国家石油化工水平的标志。请回答:
(一)乙烯大量用来生产环氧乙烷,生产工艺主要有两种:
【工艺甲】![]()
【工艺乙】![]()
根据绿色化学的原则,理想的生产工艺是原子经济性好的反应。因此,上述生产工艺中,应采用工艺__________(填“甲”或“乙”)更环保、更经济。
(二)某同学设计实验探究工业制乙烯的原理和乙烯的主要化学性质,实验装置如图所示(已知烃类都不与碱反应)。请回答下列问题:
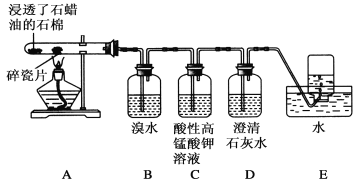
(1)工业制乙烯的实验原理是烷烃(液态)在催化剂和加热条件下发生反应生成不饱和烃。例如,石油分馏产物之一的十六烷烃发生反应:C16H34![]() C8H18+甲,甲
C8H18+甲,甲![]() 4乙,则甲的分子式为________,乙的结构简式为____________________________________。
4乙,则甲的分子式为________,乙的结构简式为____________________________________。
(2)B装置中的实验现象可能是________,写出反应的化学方程式:________________________,其反应类型是________。
(3)C装置中可观察到的现象是____________,反应类型是________。
(4)查阅资料知,乙烯与酸性高锰酸钾溶液反应产生二氧化碳。根据本实验中装置________(填字母)中的实验现象可判断该资料是否真实。为了探究溴与乙烯反应是加成反应而不是取代反应,可以测定装置B中溶液在反应前后的酸碱性,简述其理由: __________________。
(5)通过上述实验探究,检验甲烷和乙烯的方法是________(选填字母,下同);除去甲烷中乙烯的方法是________。
A.气体通入水中
B.气体通过盛溴水的洗气瓶
C.气体通过盛酸性高锰酸钾溶液的洗气瓶
D.气体通过氢氧化钠溶液
(6)分别燃烧乙烯和甲烷,甲烷火焰明亮而乙烯产生少量黑烟,原因是___________________。
【答案】(一)乙 (1分) (二)(1)C8H16(1分) CH2=CH2(1分) (2)橙色(或橙黄色)褪去(1分)
CH2=CH2+Br2→BrCH2—CH2Br(2分) 加成反应(1分)(3)紫色(或紫红色)褪去(1分)
氧化反应(1分) (4)D(1分)若乙烯与溴发生取代反应生成HBr,其溶液酸性会显著增强(1分)
(5)BC(2分) B(1分) (6)乙烯中碳的质量分数为85.7%,大于甲烷中碳的质量分数(75%)(2分)
【解析】
试题分析:(一)由反应产物可知,工艺乙原子利用率为100%,在实际生产中,应采用工艺乙更环保、更经济。
(二)(1)根据原子守恒可知甲的分子式为C8H16,乙的分子式为C2H4,结构简式为CH2=CH2;
(2)乙烯和溴水发生加成反应,实验现象为橙色(或橙黄色)褪去,反应的方程式为CH2=CH2+Br2→BrCH2CH2Br;
(3)乙烯能够被酸性高锰酸钾溶液氧化,因此现象是紫红色褪去;
(4)CO2能使澄清石灰水变浑浊,如果D装置变浑浊,说明该资料的事实;若乙烯与溴发生取代反应生成HBr,其溶液酸性会显著增强,可以测定装置B中溶液在反应前后的酸碱性,探究溴与乙烯反应是加成反应而不是取代反应;
(5)检验甲烷和乙烯,利用乙烯能使溴水褪色或酸性高锰酸钾溶液褪色,而甲烷不行,因此选项BC正确;除去甲烷中的乙烯,不能引入新杂质,不能用酸性高锰酸钾溶液,因为产生CO2,因此采用溴水,选项B正确;
(6)乙烯中碳的质量分数为85.7%,大于甲烷中碳的质量分数(75%),所以甲烷火焰明亮而乙烯产生少量黑烟。


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】运用化学反应原理消除工业污染,保护生态环境具有非常重要的意义。
(1)采取热还原法,用碳粉可将氮氧化物还原。
已知:①N2(g)+O2(g)=2NO(g) △H=+180.6kJ·mol-1;
②C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1。
则反应C(s)+2NO(g)=CO2(g)+N2(g) △H= kJ·mol-1。
(2)在催化剂作用下,将nmolSO2与nmolCl2充入容积可变的密闭容器中,发生反应:SO2(g)+ Cl2(g) ![]() SO2Cl2(g)(硫酰氯),并始终保持温度为T,压强为p。起始时气体总体积为10L,tmin时反应达到平衡状态,此时气体总体积为8L。
SO2Cl2(g)(硫酰氯),并始终保持温度为T,压强为p。起始时气体总体积为10L,tmin时反应达到平衡状态,此时气体总体积为8L。
①在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示。则v(SO2)= ___ mol/min。
②此温度下,该反应的K= 。
③相同条件下,若将0.5nmolSO2与0.5nmolCl2充入该容器,到达平衡状态时,混合物中SO2Cl2的物质的量是 。
(3)利用氨水可以将SO2和NO2吸收,原理如图所示:

NO2被吸收的离子方程式是 。
(4)利用如下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。
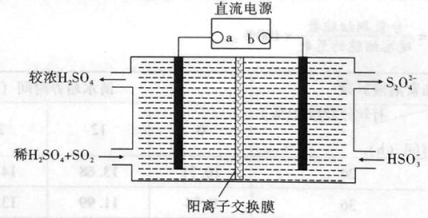
①阴极的电极反应式为 。
②在碱性条件下,用阴极排除的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1)现有如下两个反应:
A.NaOH + HCl = NaCl + H2O
B.2FeCl3 + Cu = 2FeCl2 + CuCl2
①根据两反应本质判断, 能设计成原电池(填“A”或“B”)。
②如果(A或B)不能,说明其原因 .
2)研究大气中含硫化合物(主要是SO2和H2S)的转化具有重要意义。
(1)高湿条件下,写出大气中SO2转化为HSO3-的方程式:_____________。
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:
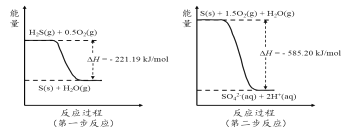
1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为______________________。
(3)二氧化硫—空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置示意图如下:

质子的流动方向为___________(“从A到B”或“从B到A”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在溶液中能大量共存的一组离子或分子是
A.NH、H+、NO、HCO
B.Na+、CH3COO-、CO、OH-
C.Na+、K+、SO、Cl2
D.K+、Al3+、SO、NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中草药秦皮中含有的七叶树内酯(每个折点表示一个碳原子,氢原子未画出),具有抗菌作用。若1 mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )
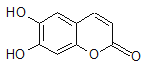
A、2 mol Br2 2 mol NaOH
B、2 mol Br2 3 mol NaOH
C、3 mol Br2 4 mol NaOH
D、4 mol Br2 4 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究实验室制乙烯及乙烯和溴水的加成反应。甲同学设计了如图所示的实验装置,并进行了实验。当温度升至170℃左右时,有大量气体产生,产生的气体通入溴水中,溴水的颜色迅速褪去。甲同学认为达到了实验目的。
乙同学仔细考察了甲同学的整个实验过程,发现当温度升到100℃左右时,无色液体开始变色,到160℃左右时,混合液全呈黑色,在170℃超过后生成气体速度明显加快,生成的气体有刺激性气味。由此他推出,产生的气体中应有杂质,可能影响乙烯的检出,必须除去。据此回答下列问题:

(1)写出甲同学实验中两个反应的化学方程式:____________________________________、____________________________________。
(2)乙同学观察到的黑色物质是__________,刺激性气体是__________。乙同学认为刺激性气体的存在就不能认为溴水褪色是乙烯的加成反应造成的。原因是(用化学方程表示):__________________。
(3)丙同学根据甲乙同学的分析,认为还可能有CO、CO2两种气体产生。为证明CO存在,他设计了如下过程(该过程可把实验中产生的有机产物除净):发现最后气体经点燃是蓝色火焰,确认有一氧化碳。

①设计装置a的作用是_____________________________________________
②浓溴水的作用是_________________________________________________,
稀溴水的作用是___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
(1)A的分子式为________________________;
(2)A与溴的四氯化碳溶液反应的化学方程式为____________________________。
(3)已知:![]()
![]()
![]() 。 请写出A与稀、冷的KMnO4溶液
。 请写出A与稀、冷的KMnO4溶液
在碱性条件下反应生成物的结构简式__________________________________;
(4)在一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%。写出此化合物的结构简式______________________________;
(5)在一定条件下,由A聚合得到的高分子化合物的结构简式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中物质的分类组合完全正确的是
编号 | A | B | C | D |
强电解质 | Ba(OH)2 | 盐酸 | HClO4 | BaSO4 |
弱电解质 | HI | CaCO3 | HClO | NH3·H2O |
非电解质 | SO2 | NH3 | Cl2 | 乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 I.在实验室利用下列装置,可制备某些气体并验证其化学性质。
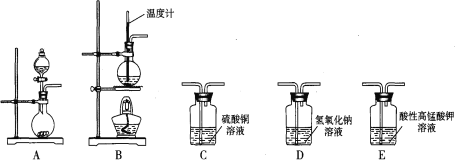
完成下列表格:
序号 | 气体 | 装置连接顺序(填字母) | 制备反应的化学方程式 |
(1) | 乙烯 | __________________ | _________________________ |
(2) | 乙炔 | A→C→E | _________________________ |
II.工业上用乙烯、氯化氢和氯气为原料,经下列各步合成聚氯乙烯(PVC):

A的结构简式是__________________________________________________;
反应④的化学方程式是_________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com