


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源:不详 题型:填空题
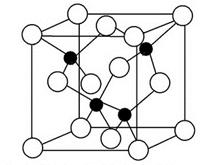
| 主 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | | | | ① | | | ② | |
| 三 | ③ | | ④ | ⑤ | | | ⑥ | ⑦ |
| 四 | ⑧ | | | | | | ⑨ | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.所有的原子核都是由质子和中子组成的 |
| B.原子的最外层电子数不超过8个 |
| C.稀有气体原子的最外层电子数均为8 |
| D.原子的次外层电子数都是8 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
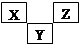
| A.X元素最高价氧化物对应的水化物具有强氧化性和不稳定性 |
| B.Y元素的常见氧化物、气态氢化物的水溶液均是酸 |
| C.Z元素的单质能与水剧烈反应 |
| D.X、Y、Z的最高价含氧酸及气态氢化物的水溶液都是强酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2S、H2O、HF的稳定性依次增强 | B.RbOH、KOH、Mg(OH)2的碱性依次减弱 |
| C.Na+、Mg2+、Al3+的氧化性依次减弱 | D.H4SiO4、H2CO3、H2SO4酸性依次增强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.只有③ | B.①④ |
| C.①②③④ | D.①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
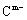 、
、 具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题: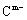 、
、 的还原性强弱顺序为:_________,(用离子符号表示)能证明其还原性强弱的离子方程式为________________________________。
的还原性强弱顺序为:_________,(用离子符号表示)能证明其还原性强弱的离子方程式为________________________________。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com