
| X | Y | 现象 | 装置 | |
| A | 氯水 | 石蕊 | 溶液先变红后褪色 | 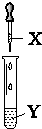 |
| B | 氨水 | AgNO3溶液 | 先产生沉淀后逐渐溶解 | |
| C | NaOH溶液 | AlCl3溶液 | 产生白色沉淀且不消失 | |
| D | 双氧水 | 酸性淀粉KI溶液 | 溶液变蓝色 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氯水中含盐酸和HClO,具有酸性和漂白性;
B.氨水与硝酸银反应先生成沉淀,氨水过量时生成银氨溶液;
C.氢氧化铝具有两性,NaOH过量时沉淀溶解;
D.双氧水与KI发生氧化还原反应生成碘,淀粉遇碘变蓝.
解答 解:A.氯水中含盐酸和HClO,具有酸性和漂白性,则观察到石蕊溶液中先变红后褪色,故A正确;
B.氨水与硝酸银反应先生成沉淀,氨水过量时生成银氨溶液,则观察到先产生沉淀后逐渐溶解,故B正确;
C.氢氧化铝具有两性,NaOH过量时沉淀溶解,则观察到先产生沉淀后逐渐溶解,故C错误;
D.双氧水与KI发生氧化还原反应生成碘,淀粉遇碘变蓝,则观察到溶液变蓝色,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与实验能力的考查,注意实验装置中试剂的加入顺序,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

 ;并写出由b生成c的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O
;并写出由b生成c的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
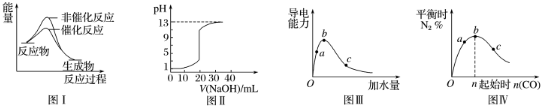
| A. | 图Ⅰ表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| B. | 图Ⅱ表示常温下,0.100 mol•L-1 NaOH溶液滴定20.00 mL 0.100 mol•L-1 HCl溶液所得到的滴定曲线 | |
| C. | 图Ⅲ表示一定质量的冰醋酸加水稀释过程中,醋酸溶液电离程度:c<a<b | |
| D. | 图Ⅳ表示反应4CO(g)+2NO2(g)?N2(g)+4CO2(g),在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2转化率c>b>a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 硝酸铵、氰化钠、电石和金属钠均属于电解质 | |
| B. | CN-中C元素显+2价,N元素显-3价,则非金属性N>C | |
| C. | 氰化钠是一种重要的化工原料,也是剧毒危险品,皮肤伤口接触、吸入、吞食微量可中毒死亡 | |
| D. | 电石属于危化品中的遇湿易燃固体,需贴上右图标志,其着火时不能用水灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
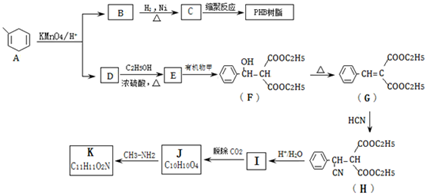
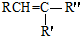 $\stackrel{KMnO_{4}/H+}{→}$RCOOH+
$\stackrel{KMnO_{4}/H+}{→}$RCOOH+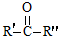
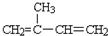 .B的结构简式是
.B的结构简式是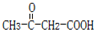 .
.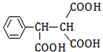 .
.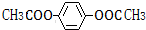 .
.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
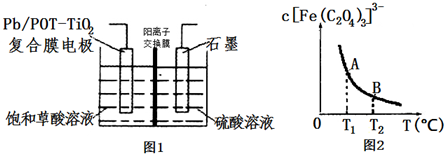
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学键 | C-C | C-H | H-H | C-O | C≡0 | H-O |
| 键能(kJ•mol-1) | 348.0 | 413.0 | 436.0 | 358.0 | 1072.0 | 463.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
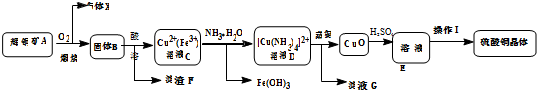

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com