
| 1000ρω |
| M |
| 1000ρω |
| M |
| 1000×1.84×98% |
| 98 |


科目:高中化学 来源: 题型:
| A、HI为0.3mol/L |
| B、I2为0.4mol/L |
| C、H2为0.2mol/L |
| D、HI为0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
A、N2的电子式: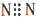 | ||
B、S2-的结构示意图: | ||
C、质子数为53、中子数为78的碘原子:
| ||
| D、16O2与18O3互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+、Na+、Cu2+、Al3+ |
| 阴离子 | SO42-、HCO3-、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
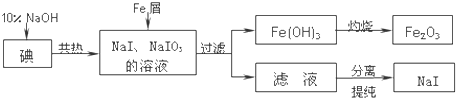
查看答案和解析>>
科目:高中化学 来源: 题型:

| NH3?H2O的Kb | Zn2+完全沉淀的pH | Zn(OH)2溶于碱的pH |
| 1.8×10-5 | 8.9 | >11 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com