
取五等份NO2,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:2NO2(g)⇌N2O4(g),△H<0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图.下列示意图中,可能与实验结果相符的是( )
|
| A. |
| B. |
| C. |
| D. |
|
| 体积百分含量随温度、压强变化曲线. | |
| 专题: | 化学平衡专题. |
| 分析: | 在恒容状态下,在五个相同的容器中同时通入等量的NO2,反应相同时间.那么则有两种可能,一是已达到平衡状态,二是还没有达到平衡状态,仍然在向正反应移动.若5个容器在反应相同时间下,均已达到平衡,因为该反应是放热反应,温度越高,平衡向逆反应方向移动,NO2的百分含量随温度升高而升高;若5个容器中有未达到平衡状态的,那么温度越高,反应速率越大,会出现温度高的NO2转化得快,导致NO2的百分含量少的情况,在D图中转折点为平衡状态,转折点左侧为未平衡状态,右侧为平衡状态. |
| 解答: | 解:A.因为该反应是放热反应,温度越高,平衡向逆反应方向移动,NO2的百分含量随温度升高而升高,故A错误; B.因为该反应是放热反应,温度越高,平衡向逆反应方向移动,NO2的百分含量随温度升高而升高,故B正确; C.若5个容器中有未达到平衡状态的,那么温度越高,反应速率越大,会出现温度高的NO2转化得快,导致NO2的百分含量少的情况,不可能出现NO2的百分含量不变的情况,故C错误; D.在D图中转折点为平衡状态,转折点左则为未平衡状态,右则为平衡状态,反应是放热反应,温度升高,平衡向逆反应方向移动,故D正确. 故选BD. |
| 点评: | 本题考查化学反应限度及平衡移动原理及其应用,题目难度中等,注意分析温度对平衡移动的影响. |


科目:高中化学 来源: 题型:
把放在空气中一段时间的5.0 g铝片投入盛有500 mL 0.5 mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如图的坐标曲线来表示,回答下列问题:
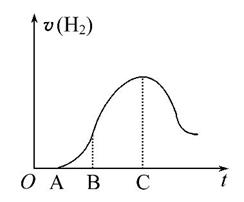
(1)曲线OA段不产生氢气的原因是 ,
有关的离子方程式是 。
(2)曲线AB段产生氢气的速率较慢的原因是 。
(3)曲线BC段产生氢气的速率较快的主要原因
。
(4)曲线到C以后,产生氢气的速率逐渐下降的主要原因是
。
查看答案和解析>>
科目:高中化学 来源: 题型:
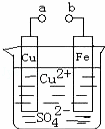
某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )
|
| A. | a和b不连接时,铁片上会有金属铜析出 |
|
| B. | a和b用导线连接时,铜片上发生的反应为:Cu2++2e﹣=Cu |
|
| C. | 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
|
| D. | a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
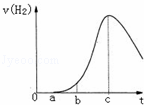
把在空气中久置的铝片5.0g投入盛有 500mL 0.5mol•L﹣1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v与反应时间t可用如图的坐标曲线来表示,下列推论错误的是( )
|
| A. | t由0→a段不产生氢气是因为表面的氧化物隔离了铝和硫酸溶液 |
|
| B. | t由b→c段产生氢气的速率增加较快的主要原因之一是温度升高 |
|
| C. | t>c产生氢气的速率降低主要是因为溶液中c(H+)降低 |
|
| D. | t=c时反应处平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
灰锡(以粉末状存在)和白锡是锡的两种同素异形体.已知:
①Sn(s,白)+2HCl(aq)═SnCl2(aq)+H2(g)△H1
②Sn(s,灰)+2HCl(aq)═SnCl2(aq)+H2(g)△H2
③Sn(s,灰)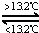 Sn(s,白)△H3=+2.1kJ•mol﹣1,
Sn(s,白)△H3=+2.1kJ•mol﹣1,
下列说法正确的是( )
|
| A. | △H1>△H2 |
|
| B. | 锡在常温下以灰锡状态存在 |
|
| C. | 灰锡转为白锡的反应是放热反应 |
|
| D. | 锡制器皿长期处在低于13.2℃的环境中,会自行毁坏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
据报道,我国拥有完全自主产权的氢氧燃料电池车已经在奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液。下列有关电池的叙述不正确的是( )
A.负极反应式为2H2+4OH--4e-====4H2O
B.工作一段时间后,电解液中的KOH的物质的量不变
C.该燃料电池的总反应方程式为:2H2+O2====2H2O
D.用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.1 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学用语正确的是( )
|
| A. | 氯化钠的电子式:Na: |
|
| B. | 乙烯的结构简式:C2H4 |
|
| C. | 硅的原子结构示意图: |
|
| D. | 硫酸的电离方程式:H2SO4=H22++SO42 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在298 K时,实验测得溶液中的反应:H2O2+2HI====2H2O+I2,在不同浓度时的化学反应速率见下表,由此可推知当c(HI)=0.500 mol·L-1,c(H2O2)=0.400 mol·L-1时的反应速率为( )
| 实验编号 | 1 | 2 | 3 | 4 | 5 |
| c(HI)/mol·L-1·min-1 | 0.100 | 0.200 | 0.300 | 0.100 | 0.100 |
| c(H2O2)/mol·L-1·min-1 | 0.100 | 0.100 | 0.100 | 0.200 | 0.300 |
| v/mol·L-1·s-1 | 0.007 60 | 0.015 3 | 0.022 7 | 0.015 1 | 0.022 8 |
A.0.038 0 mol·L-1·s-1 B.0.152 mol·L-1·s-1
C.0.608 mol·L-1·s-1 D.0.760 mol·L-1·s-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com