
 已知A(g)+B(g)?C(g)+D(s)反应的平衡常数与温度的关系如下:
已知A(g)+B(g)?C(g)+D(s)反应的平衡常数与温度的关系如下:| 温度℃ | 700 | 800 | 880 | 1000 | 1200 |
| 平衡常数 | 1.0 | 10.0 | 12.5 | 16.1 | 17.7 |
 .
. 分析 (1)K为生成物浓度幂之积与反应物浓度幂之积的比,由表格数据可知,温度越高,K越大;
(2)800℃时,K=10.0,初始2mim内A的平均反应速率为0.01mol•L-1•min-1,转化的A为0.02mol/L,则
A(g)+B(g)?C(g)+D(s)
开始 0.08 0.14 0
转化 0.02 0.02 0.02
2min 0.06 0.12 0.02
结合Qc与K的关系判断是否为平衡状态,再结合平衡常数不变计算A的平衡含量;
(3)结合平衡的特征“等、定”及衍生的物理量判定平衡;
(4)880℃时,互为相反的两个反应的K互为倒数关系;
(5)某温度时,平衡浓度符合下式:c(A).c(B)=c(C),可知K=$\frac{c(C)}{c(A)c(B)}$=1;
(6)升高温度,反应速率加快,平衡正向移动.
解答 解:(1)由A(g)+B(g)?C(g)+D(s),纯固体不能代入K的表达式中,K=$\frac{c(C)}{c(A)c(B)}$,由表格数据可知,温度越高,K越大,则正反应为吸热反应,△H>0,
故答案为:$\frac{c(C)}{c(A)c(B)}$;>;
(2)800℃时,K=10.0,初始2mim内A的平均反应速率为0.01mol•L-1•min-1,转化的A为0.02mol/L,则
A(g)+B(g)?C(g)+D(s)
开始 0.08 0.14 0
转化 0.02 0.02 0.02
2min 0.06 0.12 0.02
则2min时c(A)=0.06mol•L-1,C的物质的量为0.02mol/L×5L=0.1mol;此时,Qc=$\frac{0.02}{0.06×0.12}$=2.78<K,平衡正向移动,
A(g)+B(g)?C(g)+D(s)
开始 0.08 0.14 0
转化 x x x
平衡 0.08-x 0.14-x x
$\frac{x}{(0.08-x)(0.14-x)}$=10,
解得x=0.04mol/L,
平衡后A的百分含量为$\frac{0.04}{0.04+0.1+0.04}$×100%=22.2%,
反应达到平衡时再向容器中充入0.4molA,平衡正向移动,则
A(g)+B(g)?C(g)+D(s)
开始 0.04+0.08 0.1 0.04
转化 x x x
平衡 0.12-x 0.1-x 0.04+x
$\frac{0.04+x}{(0.12-x)(0.1-x)}$=10.0,
解得x=0.027mol/L,
平衡时A的含量为$\frac{0.12-0.027}{0.12+0.1+0.04-0.027}$×100%=39.9%,
则再次达到平衡后A的百分含量与第一次平衡相比增大,
故答案为:0.06;0.1;增大;
(3)a.该反应为气体体积不等的反应,压强不随时间改变,达到平衡状态,故选;
b.v(A):v(b)=1:1始终存在,不能判断达到平衡状态,故不选;
c.单位时间内消耗A和B的物质的量相等,只体现正反应速率关系,不能判定平衡,故不选;
d.C的百分含量保持不变,可知浓度不变,为平衡状态,故选;
故答案为:ad;
(4)880℃时,A(g)+B(g)?C(g)+D(s)反应的平衡常数K=12.5,互为相反的两个反应的K互为倒数关系,则880℃时,反应 C(g)+D(s)?A(g)+B(g)的平衡常数的值为$\frac{1}{12.5}$=0.08,故答案为:0.08;
(5)某温度时,平衡浓度符合下式:c(A).c(B)=c(C),可知K=$\frac{c(C)}{c(A)c(B)}$=1,则该此时的温度为700℃,故答案为:700;
(6)升高温度,反应速率加快,平衡正向移动,平衡时A的物质的量比原平衡的小,在1200℃时A的物质的量的变化曲线图为 ,
,
故答案为: .
.
点评 本题考查化学平衡的计算,为高频考点,把握表中数据、平衡三段法、K的计算、平衡判定为解答的关键,侧重分析与计算能力的考查,注意(2)为解答的难点,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2是还原剂 | B. | NH3是氧化剂 | C. | O2得到电子 | D. | NH3发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如右下图.下列有关该氢氧燃料电池的说法不正确的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如右下图.下列有关该氢氧燃料电池的说法不正确的是( )| A. | 该电池工作时将电能转化为化学能 | B. | 电子从电极b经外电路流向电极a | ||
| C. | 该电池中的电极b是正极 | D. | 在电极a上发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
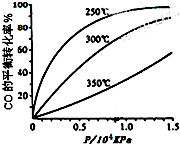 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
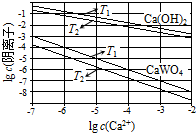 已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应
已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应| 温度/℃ | 25 | 50 | 90 | 100 |
| K | 79.96 | 208.06 | 222.88 | 258.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com