
| A. | ②③④ | B. | ①②③④ | C. | ②③ | D. | ①②③ |
分析 既能与盐酸反应又能与氢氧化钠溶液反应的物质有:两性化合物(如Al2O3、Al(OH)3等)、弱酸的铵盐(如(NH4)2CO3等)、弱酸的酸式盐(NaHCO3、NaHS等)、单质(如Al)、氨基酸等.
解答 解:①NaHSO4只与氢氧化钠反应,故错误;
②Al2O3两性物质,既能与酸反应又能与碱反应,均生成盐和水,故正确;
③NaHSO3与盐酸强酸制弱酸,与氢氧化钠生成亚硫酸钠和水,所以既能与盐酸反应,又能与氢氧化钠溶液反应,故正确;
④(NH4)2CO3既能与盐酸反应,又能与氢氧化钠溶液反应,故正确;
故选:A.
点评 本题考查了元素化合物的性质,题目难度不大,明确物质的性质是解本题的关键,注意总结中学常见的既能与酸反应又能与碱反应的物质.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 33% | C. | 50% | D. | 89% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
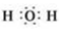 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子晶体中一定存在离子键 | B. | 原子晶体中,只存在共价键 | ||
| C. | 分子晶体的水溶液一定不导电 | D. | 稀有气体能形成分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液洗气时发生反应的离子方程式为:2OH-+Cl2=Cl-+ClO-+H2O | |
| B. | 根据实验可以得出中性条件下,氧化性Cl2>O2 | |
| C. | 根据实验可以得出反应物的浓度和溶液的pH会影响物质的氧化性 | |
| D. | 当电路中通过2mol电子时,阳极可收集到标准状况下气体体积为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)氮是地球上含量丰富的一种元素,氮及其化合物在工、农业生产和生活中有着重要作用.
(1)氮是地球上含量丰富的一种元素,氮及其化合物在工、农业生产和生活中有着重要作用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 实验操作 | 实验现象 | 解释 |
| A | 将铜粉加入1.0mol/LFe(SO4)3溶液中 | 溶液变蓝 | 金属铁比铜活泼 |
| B | 将在Na2SiO3稀溶液中浸泡过的小木条立即置于酒精灯外焰 | 小木条不易燃烧 | Na2SiO3溶液有阻燃的作用 |
| C | 向NaBr溶液中滴加氯水 | 溶液颜色变成橙黄色 | 氯水中含有HClO |
| D | 将一小块金属钠放置于坩埚里加热 | 钠块先融化成小球,再燃烧 | 钠的熔点比钠的着火点低 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com