
![]() +
+![]() +H+
+H+![]() RO2+Mn2++H2O
RO2+Mn2++H2O
①x值为_________。
②参加反应的H+的物质的量为________ mol。
(2)在100 mL 0.100 mol·L-1的FeBr2溶液中通入Cl2,若要使反应完全,则至少需标准状况下Cl2多少升?
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 硼是一种重要的非金属元素,单质硼可以通过硼镁矿Mg2B2O5?H2O来制取.
硼是一种重要的非金属元素,单质硼可以通过硼镁矿Mg2B2O5?H2O来制取.查看答案和解析>>
科目:高中化学 来源:江苏省启东中学2012届高三上学期期中考试化学试题 题型:022
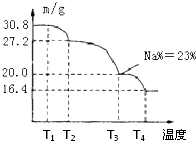
饮用水中含有一定浓度的NO3-将对人类健康产生危害,NO3-能氧化人体血红蛋白中的Fe(Ⅱ),使其失去携氧功能.为了降低饮用水中NO3-的浓度,某兴趣小组提出如下方案:
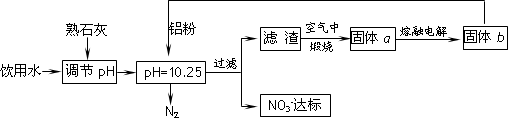
请回答下列问题:
(1)已知过滤后得到的滤渣是一种混合物,则在溶液中铝粉和NO3一反应的离子方程式为________.
(2)该方案中选用熟石灰调节pH,理由是________、________,在调节pH时,若pH过大或过小都会造成________的利用率降低.
(3)用H2催化还原法也可降低饮用水中NO3-的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为________.
(4)饮用水中的NO3-主要来自于NH4+.已知在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-.两步反应的能量变化示意图如下:
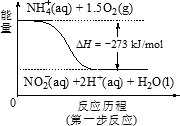
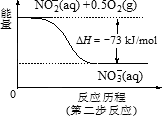
试写出1 mol ![]() (aq)全部氧化成NO3-(aq)的热化学方程式是________.
(aq)全部氧化成NO3-(aq)的热化学方程式是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)、根据电离平衡移动原理完成下列表格
(1)已知:CH3COOH为弱电解质,在醋酸溶液中,当改变条件后,完成表格中的变化情况
| 外加条件 | 平衡移动方向 | C(OH -) | C(CH3COO -) |
| 升温 |
| 不填 | 不填 |
| 加水 |
|
| 不填 |
| 加盐酸 | 不填 |
|
|
| 加少量氢氧化钠固体 | 不填 | 不填 |
|
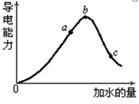
(2)在一定温度下,冰醋酸加水稀释过中溶液的导电能力如下图所示,请回答:
①写出醋酸的电离方程式________________。
②a、b、c三点溶液中氢离子浓度由小到大的顺序为__________________。
③a、b、c三点中醋酸的电离程度最大的是 。
④取甲、乙两份等体积c点的溶液,甲用蒸馏水稀释10倍,,乙用蒸馏水稀释100倍,则稀释后甲、乙两溶液中的H+浓度:C(H+)甲_____10C(H+)乙(填“大于”、“小于”或 “等于”),
查看答案和解析>>
科目:高中化学 来源:2011-2012学年云南蒙自高中高二上学期期中考试化学试卷 题型:填空题
(14分)、根据电离平衡移动原理完成下列表格
(1)已知:CH3COOH为弱电解质,在醋酸溶液中,当改变条件后,完成表格中的变化情况
| 外加条件 | 平衡移动方向 | C(OH -) | C(CH3COO -) |
| 升温 | | 不填 | 不填 |
| 加水 | | | 不填 |
| 加盐酸 | 不填 | | |
| 加少量氢氧化钠固体 | 不填 | 不填 | |
查看答案和解析>>
科目:高中化学 来源:2013届云南蒙自高中高二上学期期中考试化学试卷 题型:填空题
(14分)、根据电离平衡移动原理完成下列表格
(1)已知:CH3COOH为弱电解质,在醋酸溶液中,当改变条件后,完成表格中的变化情况
|
外加条件 |
平衡移动方向 |
C(OH -) |
C(CH3COO -) |
|
升温 |
|
不填 |
不填 |
|
加水 |
|
|
不填 |
|
加盐酸 |
不填 |
|
|
|
加少量氢氧化钠固体 |
不填 |
不填 |
|
(2)在一定温度下,冰醋酸加水稀释过中溶液的导电能力如下图所示,请回答:

①写出醋酸的电离方程式________________。
②a、b、c三点溶液中氢离子浓度由小到大的顺序为__________________ 。
③a、b、c三点中醋酸的电离程度最大的是 。
④取甲、乙两份等体积c点的溶液,甲用蒸馏水稀释10倍,,乙用蒸馏水稀释100倍,则稀释后甲、乙两溶液中的H+浓度:C(H+)甲_____ 10C(H+)乙(填“大于”、“小于”或 “等于”),
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com