
| A. | V(B)=0.6 mol/(L•min) | B. | V(A)=0.3 mol/(L•min) | ||
| C. | V(B)=0.02/(L•S) | D. | V(C)=0.5 mol/(L•min) |
分析 由于不同物质表示的速率之比等于其化学计量数之比,故速率之比与其化学计量数的比值越大,表示的反应速率越快,注意保持单位一致,据此解答.
解答 解:由于不同物质表示的速率之比等于其化学计量数之比,故速率之比与其化学计量数的比值越大,表示的反应速率越快,
A.$\frac{{V}_{(B)}}{3}$=0.2 mol/(L•min);
B.$\frac{{V}_{(A)}}{1}$=0.3 mol/(L•min);
C.V(B)=0.02/(L•s)=1.2 mol/(L•min),$\frac{{V}_{(B)}}{3}$=0.4 mol/(L•min);
D.$\frac{{V}_{(C)}}{2}$=0.25 mol/(L•min),
故选C.
点评 本题考查化学反应速率比较,难度不大,注意理解速率规律,也可以利用归一法计算比较,但利用比值法更为简单,对于选择题更适用.


科目:高中化学 来源: 题型:解答题
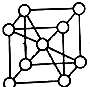 R、X、Y、Z是位于前四周期的元素,基态R原子核外电子占据3个能级,且每个能级上电子数相等,Y、X能组成两种阳、阴离子个数比为1:1、2:1型化合物.ZX2是常见的催化剂、氧化剂和电极材料,R、X、Y组成一种常见化合物,其水溶液常用于餐具的洗涤剂.R、X、Y原子的质子数之和等于Z的质子数.
R、X、Y、Z是位于前四周期的元素,基态R原子核外电子占据3个能级,且每个能级上电子数相等,Y、X能组成两种阳、阴离子个数比为1:1、2:1型化合物.ZX2是常见的催化剂、氧化剂和电极材料,R、X、Y组成一种常见化合物,其水溶液常用于餐具的洗涤剂.R、X、Y原子的质子数之和等于Z的质子数.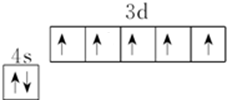 ;上述四种元素中,第一电离能最小的元素的基态原子核外有11种不同的电子运动状态.
;上述四种元素中,第一电离能最小的元素的基态原子核外有11种不同的电子运动状态.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
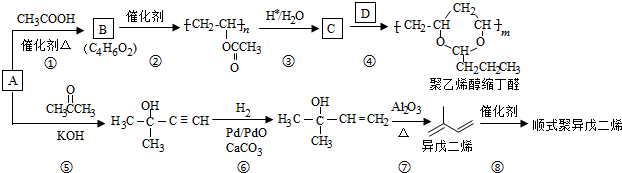
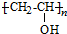 、CH3CH2CH2CHO.
、CH3CH2CH2CHO.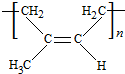 .
.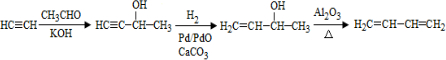 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除零族元素外,非金属元素全部都是主族元素 | |
| B. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 | |
| C. | 同周期ⅡA族与ⅢA族元素的原子序数之差可能为25 | |
| D. | 同族上下相邻两种元素的原子序数之差可能为32 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
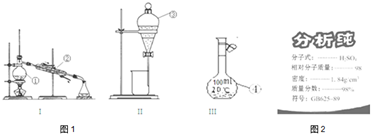
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.0225 mol/(L•min) | B. | 0.05 mol/(L•min) | ||
| C. | 0.045 mol/(L•min) | D. | 0.01 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
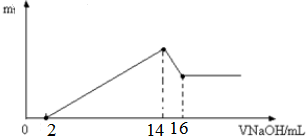
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com