
| A. | 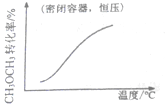 CH3OCH3(g)+3H2O(g)?6H2(g)+2CO2(g):△H>0 | B. | 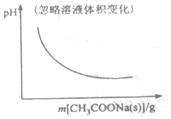 CH3COOH?H++CH3COO- | ||
| C. | 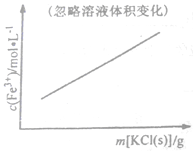 FeCl3+3KSCN?Fe(SCN)3+3KCl | D. | 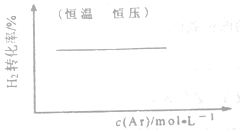 N2(g)+3H2(g)?2NH3(g) |
分析 A.正反应吸热,升高温度,化学平衡正向移动;
B.向醋酸溶液中加入醋酸钠固体,增大了c(CH3COO-),电离平衡逆向移动;
C.根据反应的离子方程式为Fe3++3SCN-?Fe(SCN)3判断;
D.保持压强不变,充入氩气,平衡逆向移动.
解答 解:A.正反应吸热,升高温度,化学平衡正向移动,CH3OCH3的转化率增大,故A正确;
B.向醋酸溶液中加入醋酸钠固体,增大了c(CH3COO-),CH3COOH?H++CH3COO-逆向移动,c(H+)减小,pH值增大,故B错误;
C.该反应的实质为Fe3++3SCN-?Fe(SCN)3,加入KCl,化学平衡不移动,因此c(Fe3+)不变,故C错误;
D.保持压强不变,充入氩气,相当于减小压强,平衡逆向移动,则氢气的转化率减小,故D错误.
故选A.
点评 本题考查以图象为载体综合考查化学反应与能量变化、电离平衡、化学平衡的移动等知识,为高频考点,侧重考查学生的分析能力,注意把握图象曲线变化的特点以及平衡移动的影响因素,难度中等.


科目:高中化学 来源: 题型:选择题
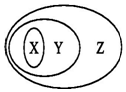 用如图表示的一些物质或概念间的从属关系中不正确的是( )
用如图表示的一些物质或概念间的从属关系中不正确的是( )| X | Y | Z | |
| A | 氧化物 | 化合物 | 纯净物 |
| B | 置换反应 | 氧化还原反应 | 化学反应 |
| C | 非金属氧化物 | 酸性氧化物 | 氧化物 |
| D | 金属 | 单质 | 纯净物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅与任何酸都不反应 | |
| B. | 硅太阳能电池、计算机芯片、光导纤维都用到硅单质 | |
| C. | 硅的性质很稳定,能以单质形式存在于地壳中 | |
| D. | 水泥路桥、门窗玻璃、砖瓦、陶瓷餐具所用材料为硅酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

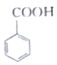 (苯甲酸)+C2H5OH$?_{△}^{浓硫酸}$
(苯甲酸)+C2H5OH$?_{△}^{浓硫酸}$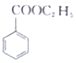 (苯甲酸乙酯)+H2O
(苯甲酸乙酯)+H2O| 物质 | 苯甲酸 | 乙醇 | 苯甲酸乙酯 |
| 熔点/℃ | 122.1 | -117.3 | -34.6 |
| 沸点/℃ | 249 | 78.3 | 213 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
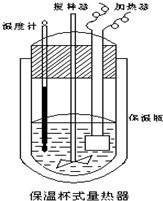 在如图所示的量热计中,将100mL0.50mol•L-1CH3COOH溶液与100mL0.55mol•L-1NaOH溶液混合,温度从25.0℃升高到27.7℃.已知该量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为4.184J•g-1•℃-1,两溶液的密度均近似为1g•mL-1.下列说法错误的是( )
在如图所示的量热计中,将100mL0.50mol•L-1CH3COOH溶液与100mL0.55mol•L-1NaOH溶液混合,温度从25.0℃升高到27.7℃.已知该量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为4.184J•g-1•℃-1,两溶液的密度均近似为1g•mL-1.下列说法错误的是( )| A. | CH3COOH溶液与NaOH溶液的反应为吸热反应 | |
| B. | 所加NaOH溶液过量,目的是保证CH3COOH溶液完全被中和 | |
| C. | 若量热计的保温瓶绝热效果不好,则所测△H偏大 | |
| D. | CH3COOH的中和热△H为-53.3KJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10 m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 最低负化合价 | -2 | -3 | -1 | -3 |
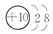 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com