
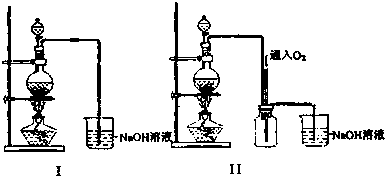
分析 (1)烧瓶中发生Cu与稀硝酸的氧化还原反应;
(2)图Ⅱ中中间的装置可防止倒吸,并发生氮的氧化物与水的反应;
(3)①在酸性条件下,铜单质能被氧气氧化为铜离子;
②调节溶液的pH3.7~4.4;
(4)①铜在酸性条件能被双氧水氧化;
②过氧化氢不稳定,温度过高易分解生成水和氧气;酒精极易蒸发带走水分;根据铜原子守恒得铜和五水硫酸铜的关系,求出CuSO4•5H2O 质量,然后求出产率.
解答 解:(1)烧瓶中发生Cu与稀硝酸的氧化还原反应,化学方程式为3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,故答案为:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
或Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O;
(2)由装置比较可知,图Ⅱ中多出的装置能①溶液不导管不直接接触,防止倒吸,②NO与氧气及碱反应,使有害气体能被完全吸收,故答案为:增加了安全瓶;有利于有毒气体被完全吸收;
(3)①在酸性条件下,铜单质能被氧气氧化为铜离子,离子方程式:2Cu+4H++O2$\frac{\underline{\;Fe_{2}+\;}}{\;}$2Cu2++2H2O,FeSO4作催化剂,故答案为:2Cu+4H++O2$\frac{\underline{\;Fe_{2}+\;}}{\;}$2Cu2++2H2O或4Fe2++O2+4H+═4Fe3++2H2O,2Fe3++Cu═2Fe2++Cu2+;催化剂;
②加入CuO[或Cu(OH)2或CuCO3],调节溶液的pH3.7~4.4,将沉淀滤去,故答案为:向反应后的溶液中加入CuO[或Cu(OH)2或CuCO3],调节溶液的pH3.7~4.4,将沉淀滤去;
(4)①铜在酸性条件能被双氧水氧化,离子方程式Cu+H2O2+2H+═Cu2++2H2O,故答案为:Cu+H2O2+2H+═Cu2++2H2O;
②根据双氧水加热易分解的性质分析,过氧化氢不稳定,温度过高易分解生成水和氧气;酒精极易蒸发带走水分,加速晶体晾干,减少晶体的溶解;设3.2g铜生成五水硫酸铜的质量为xg,根据铜原子守恒得铜和五水硫酸铜的关系式为:
Cu→CuSO4•5H2O
64g 250g
3.2g xg
所以x=12.5
理论上生成CuSO4•5H2O 12.5克,故产率为$\frac{10g}{12.5g}$×100%=80%,故答案为:防止双氧水分解;酒精极易蒸发带走水分,加速晶体晾干,减少晶体的溶解;80%.
点评 本题考查硫酸铜制备实验方案的设计,明确装置的作用及发生的氧化还原反应是解答本题的关键,注意除杂的方法及物质的成分、性质的差异、盐类水解的知识来解答,综合性较强,题目难度较大.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 8.5g | B. | 10.8g | C. | 6.2g | D. | 4.6g |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁沈阳东北育才学校高二阶段考一化学卷(解析版) 题型:填空题
在一定温度下,向一固定容积的密闭容器中加入 1mol A和 2mol B,发生下述反应:A(g)+2B(g) 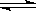 3C(g)+2D(s) △H>0。达到平衡时生成
3C(g)+2D(s) △H>0。达到平衡时生成 了1.8 mol C。
了1.8 mol C。
(1)在相同条件下,若向该容器中改为加入0.3mol A、0.6 mol B,要使平衡混合气体中C物质的体积分数与原平衡的相同,在D足量时,则还应加入 mol的物质C。
(2)若维持容器的体积和温度不变,反应从逆反应方向开始,按不同的配比作为起始物质,达到平衡时C仍为1.8 mol 。则D的起始物质的量n(D)应满足的条件是:n(D)___________。
当改变温度或压强时,有可能改变物质的聚集状态,对平衡产生影响。回答(3)(4)
(3)若升高平衡体系温度,当再次达到平衡后,测得两次平衡条件下混合气体的平均相对分子质量未发生改变,试解释形成这种结果的可能原因是:_________________;
(4)若将容器改为容积可变的容器,在一定温度和常压下,建立上述平衡之后,A的物质的量浓度为a mol/L。现持续增大压强,当:
①当压强为原来1.5倍时,A的平衡时物质的量浓度为m mol/L,测得m=1.5a;
②当压强为原来10倍时,A的平衡时物质的量浓度为n mol/L,测得n >10 a;
③当压强为原来100倍时,A的平衡时物质的量浓度为p mol/L,测得p<100a。
试解释形成这种结果的可能的原因:
①1.5倍时: ;
②10倍时: ;
③100倍时:  。
。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁沈阳东北育才学校高二阶段考一化学卷(解析版) 题型:选择题
将0.1mol•L﹣1的KI溶液和0.05mol•L﹣1 Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“2Fe3++2I﹣ 2Fe2++I2”的是( )
2Fe2++I2”的是( )
实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成(用于证明Fe2+存在) |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
A.①和② B.②和④ C.②和③ D.①和③
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
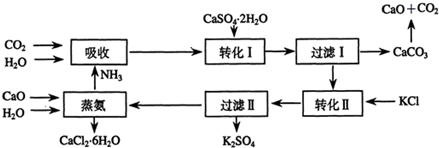
| 所含离子 | 检验方法 |
| K+ | 取少量滤液于试管中,通过焰色反应,火焰呈紫色(透过蓝色钴玻璃) |
| NH4+ | 取少量滤液于试管中,并向其中加入NaOH微热,有刺激性气味产生(该气体可使湿润红色石蕊试纸变蓝) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要持续加热才能发生的反应一定是吸热反应 | |
| B. | MnO2能加速H2O2的分解,是因为MnO2可以降低反应所需的活化能 | |
| C. | 分别稀释10mLpH=1的盐酸和醋酸至100mL,后者pH变化大,说明醋酸是弱酸 | |
| D. | 向橙色的K2Cr2O7溶液中滴加NaOH溶液,溶液颜色变黄,说明化学平衡发生了移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同浓度下列溶液中:①(NH4)2SO4 ②NH4HCO3 ③NH4Cl④NH3•H2O,c(NH4+)由大到小的顺序是:①>③>②>④ | |
| B. | 常温时,将等体积的盐酸和氨水混合后,pH=7,则c (NH4+)>c (Cl-) | |
| C. | 0.2 mol•L-1Na2CO3溶液中:c (OH-)=c (HCO3-)+c (H+)+c (H2CO3) | |
| D. | 0.01 mol•L-1的NH4Cl溶液与0.05mol•L-1的NaOH溶液等体积混合:c (Cl-)>c (NH4+)>c (Na+)>c (OH-)>c (H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量是4g | B. | 标准状况下的体积约为33.6L | ||
| C. | 电子数是3mol | D. | 分子数是9.03×1023 个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com