
实验室用NaOH固体配制0.1 000mol·L-1NaOH溶液500mL.
(1)用托盘天平称取NaOH固体________g.溶液配制过程用到下列玻璃仪器,按首次使用的先后顺序依次是________ (填仪器选项符号)
A.玻璃棒 B.胶头滴管 C.烧杯 D.500mL容量瓶
(2)用所配制的0.1000mol·L-1NaOH溶液通过中和滴定测定一元弱酸HA溶液浓度,每次滴定取用的HA溶液均为20.00mL,使用酚酞溶液为指示剂,滴定终点的标志是____________________________。滴定的实验数据记录:
| 滴定次数 | NaOH溶液体积(mL) | |
| V1 | V2 | |
| 1 | 3.05 | 44 |
| 2 | 1.45 | 41.5 |
| 3 | 7.65 | 47.6 |
(1)2.0 C A D B
(2)溶液恰好出现红色,且红色半分钟内不褪去。 0.2000 mol/L
(3)B C
(4)5.000×10-2a
解析试题分析:(1)n="c·V=0.1000mol/L×0.5L=0.0500mol,m=n·M=0.0500mol×58." 5g/mol="2.9g.." 在溶液配制过程用到下列玻璃仪器,按首次使用的先后顺序依次是C A D B。
(2)以酚酞溶液为指示剂,用已知浓度的碱来滴定未知浓度的酸溶液,由于指示剂在酸溶液中,开始为无色,当滴定终点时的标志是溶液恰好出现红色,且红色半分钟内不褪去。第一次消耗的碱的体积为44-3.05=40.95ml,第二次消耗的碱的体积为41.5-1.45=40.05ml;第三次消耗的碱的体积为:47.6-7.65=39.95ml.可见第一次误差较大,去掉。平均消耗的碱的体积为(40.05ml+39.95ml)÷2=40.00ml.c(HA)=c(NaOH)·V(NaOH)/V(HA)=0.1000mol·L-1×40.00ml÷20.00ml=0.2000mol/L.
(3)A.滴定管就应该用待装液润洗。正确,无误差。B.锥形瓶用待装液润洗,就会使消耗的标准碱溶液体积偏大,以此为标准计算的酸溶液的浓度就偏高。C.滴定前滴定管末端气泡没赶尽,会使开始时的读数偏小,后来读数正常,则消耗的碱溶液的体积就偏大,以此为标准计算的酸溶液的浓度就偏高。D.滴定前平视观察读数,滴定后俯视观察读数,则消耗的碱溶液的体积就偏小,以此为标准计算的酸溶液的浓度就偏低。E.所用的标准液(NaOH溶液)浓度偏高,则消耗的碱溶液的体积偏小,以此为标准计算的酸溶液的浓度就偏低。因此操作可能导致所测溶液浓度偏高的是B 、C。
(4)用pH计测得该HA溶液pH=a,c(H+)=10-amol/L.c(A-)=10-amol/L,c(HA)=" 0.2000" mol/L.则在实验温度下HA的Ka=(10-amol/L×10-amol/L)÷0.2000 mol/L=5.000×10-2a.
考点:考查物质的量浓度溶液的配制、酸碱中和滴定终点的判断、数据处理、误差分析及电离平衡常数的计算的知识。


科目:高中化学 来源: 题型:填空题
许多硫的含氧酸盐在医药、化工等方面有着重要的用途。
(1))重晶石(BaS04)常作胃肠道造影剂。
已知:常温下,Ksp(BaSO4)=1.1×10-10,向BaSO4悬浊液中加入硫酸,当溶液的pH=2时, 溶液中 c(Ba2+)= 。
(2)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H20]常作分析剂。
①检验晶体中含有NH4+的方法为_______。
②等物质的量浓度的四种稀溶液:
a.(NH4)2Fe(SO4)2 b.NH4HSO4 c.(NH4)2SO4 d.(NH4)2SO3
其中C(NH4+)由大到小的顺序为 (填选项字母)。
(3)过二硫酸钾(K2S2O8)常作强氧化剂,Na2S2O3常作还原剂。
①K2S2O8溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色, 该反应的离子方程式为
②用铂作电极,电解H2SO4和K2SO4的混合溶液可以制备K2S2O8,其阳极的电极反应式为_____ __电解过程中阴极附近溶液的pH将______ (填“增大”、“减小”或“不变”)
③产品中K2S2O8的含量可用碘量法测定。操作步骤为:称取0.3g产品于碘量瓶中,加50 mL水溶解;加入4.000 g KI固体(稍过量),振荡使其充分反应;加入适量醋酸溶液酸化,以______为指示剂,用0.1000 mol·L-1 Na2S2O3标准液滴定至终点(已知:I2+2S2O32-=2I-+S4O62-)。重复2次,测得平均消耗标准液21.00mL。该产品中K2S2O8的质量分数为(杂质不参加反应) (列式并计算)。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
(1)已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10—1 | 1.8×10—5 | 4.9×10—10 | K1=4.3×10—7 K2=5.6×10—11 |



查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下某一刻度,并记下读数
④移取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是 (填编号),该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”) 。
(2)判断滴定终点的现象是:锥形瓶中溶液从 色变为________色, 且半分钟内不变色。
(3)如图是某次滴定时的滴定管中的液面,其读数为 mL。
(4)根据下列数据:请计算待测盐酸溶液的浓度为 mol/L。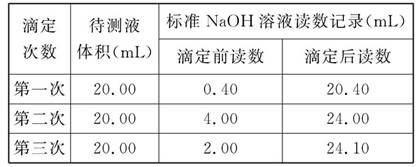
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学实验小组想要了解市场所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。
(1)该实验应选用 作指示剂,量取一定体积的白醋所用的仪器是 。
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为 mL。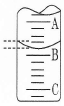
(3)为了减小实验误差,该同学一共进行了3次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为cmo1/L,3次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
为测定某品牌洗厕精的酸(盐酸)含量,某学生欲用已知物质的量浓度的NaOH溶液来测定该洗厕精(盐酸)的物质的量浓度时,选择酚酞作指示剂。请填写下列空白:
(1)碱式滴定管的使用方法,正确步骤的先后顺序为(填选项符号):
A.用氢氧化钠溶液润洗仪器并加入氢氧化钠溶液
B.放出氢氧化钠溶液进行滴定
C.调节起始读数
D.查漏,再水洗2-3遍
(2)用标准的NaOH溶液滴定待测的盐酸时,左手控制碱式滴定管的玻璃球,右手摇动锥形瓶,眼睛应注视 ;
(3)若滴定开始和结束时,碱式滴定管中的液面如上图所示:则所用NaOH溶液的体积为 mL。
(4)某学生根据三次实验分别记录有关数据如下表:
| 滴定次数 | 待测盐酸的体积/mL | 0.1000 mol/LNaOH溶液的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 2.00 | 28.15 | 26.15 |
| 第二次 | 25.00 | 1.50 | 29.50 | 28.00 |
| 第三次 | 25.00 | 0.20 | 26.55 | 26.35 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
硫酸亚锡(SnSO4)是一种重要的硫酸盐,主要用于电镀工业的镀锡、铝合金表面的氧化着色、印染工业的媒染剂、双氧水去除剂等。某研究小组设计SnSO4制备路线如下:
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成难溶物Sn(OH)Cl(碱式氯化亚锡)。
请回答下列问题:
(1)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因 。
(2)加入Sn粉的作用有两个:①调节溶液pH ② 。
(3)反应Ⅰ生成的气体为CO2,得到的沉淀是SnO。该沉淀经过滤后需漂洗,如何证明沉淀已经洗涤完全? 。
(4)多步操作包含的具体实验步骤的名称可以是: 。
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是 。
(6)该小组通过下列方法测所用锡粉样品的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl→SnCl2 + H2↑;
②加入过量的FeCl3;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:6FeCl2 + K2Cr2O7 + 14HCl →6FeCl3 + 2KCl + 2CrCl3 +7H2O
取1. 226 g 锡粉样品,经上述各步反应后,共用去0.1000 mol/L K2Cr2O7溶液32.00 mL。则该锡粉样品中锡的质量分数是
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下图是一种航天器能量储存系统原理示意图。下列说法正确的是( )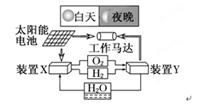
| A.该系统中只存在3种形式的能量转化 |
| B.装置Y中负极的电极反应式为:O2+2H2O+4e-=4OH- |
| C.装置X能实现燃料电池的燃料和氧化剂再生 |
| D.装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某原电池的总反应是Zn+Cu2+====Zn2++Cu,则该原电池的组成正确的是( )
| | A | B | C | D |
| 正极 | Zn | Zn | 碳棒 | Cu |
| 负极 | 碳棒 | Fe | Zn | Zn |
| 电解质溶液 | CuCl2 | H2SO4 | CuSO4 | ZnCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com