
【题目】煅烧硫铁矿(主要成分为FeS2)的反应为:4FeS2+11O2 ![]() 2Fe2O3+8SO2 . 试回答下列问题.
2Fe2O3+8SO2 . 试回答下列问题.
(1)可用哪些物质来表示该反应的化学反应速率 .
(2)某时刻时测得,生成SO2的速率为0.64mol/(Ls),则氧气减少的速率为mol/(Ls).
(3)该工业生产中将矿石粉碎的目的: .
【答案】
(1)SO2和O2
(2)0.88
(3)增大接触面积,加快反应速率
【解析】解:(1)4FeS2+11O2 ![]() 2Fe2O3+8SO2 , 化学反应速率是指单位时间内反应物浓度减小或生成物浓度增大表示,只有气体或者溶液才有浓度的变化,固体或者纯液体的浓度是定值,反应能用来表示化学反应速率的物质不能是固体和纯液体,反应中用来表示反应速率的物质为SO2和O2 , 所以答案是:SO2和O2;(2)v(SO2):v(O2)=8:11,故v(O2)=
2Fe2O3+8SO2 , 化学反应速率是指单位时间内反应物浓度减小或生成物浓度增大表示,只有气体或者溶液才有浓度的变化,固体或者纯液体的浓度是定值,反应能用来表示化学反应速率的物质不能是固体和纯液体,反应中用来表示反应速率的物质为SO2和O2 , 所以答案是:SO2和O2;(2)v(SO2):v(O2)=8:11,故v(O2)= ![]() v(SO2)=
v(SO2)= ![]() ×0.64=0.88 mol/(Ls),所以答案是:0.88 mol/(Ls);所以答案是:0.88;(3)该工业生产中将矿石粉碎的目的是增大接触面积,加快反应速率,所以答案是:增大接触面积,加快反应速率.
×0.64=0.88 mol/(Ls),所以答案是:0.88 mol/(Ls);所以答案是:0.88;(3)该工业生产中将矿石粉碎的目的是增大接触面积,加快反应速率,所以答案是:增大接触面积,加快反应速率.
【考点精析】解答此题的关键在于理解反应速率的定量表示方法的相关知识,掌握反应速率的单位:mol/(L·min)或mol/(L·s) v=△c-△t.


科目:高中化学 来源: 题型:
【题目】下图为氢氧燃烧电池原理示意图,按照此图的提示,下列叙述正确的是( )
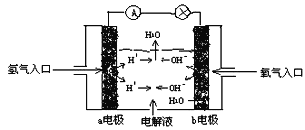
A. a电极是正极
B. b电极的电极反应为:4OH-- 4e-=2H2O + O2↑
C. 电子从a电极经由电解液传递到b电极
D. 氢氧燃烧电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为相互串联的甲乙两个电解池,X、Y为直流电源的两个电极.电解过程中,发现石墨电极附近先变红.请回答:
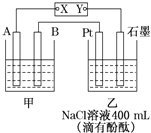
(1)电源X极为___________极(填“正”或“负”),乙池中Pt电极上的电极反应式为___________;
(2)甲池若为电解精炼铜的装置,其阴极增重12.8g,则乙池中阴极上放出的气体在标准状况下的体积为____________,电路中通过的电子为___________ mol;
(3)在(2)的情况下,若乙池剩余溶液的体积仍为400mL,则电解后所得溶液c(OH﹣)=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇脱氢可制取甲醛CH3OH(g)![]() HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图所示。下列有关说法正确的是
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图所示。下列有关说法正确的是
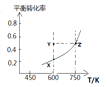
A. 该反应的正反应为放热反应
B. 600 K时,Y点甲醇的v(正)<v(逆)
C. 从Y点到Z点可通过增大压强实现
D. 从Y点到X点可通过使用催化剂实现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向容积为2 L的密闭容器中充入1 mol CO2和3 mol H2,发生如下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),5 min后反应达到平衡时c(CH3OH)为0.2 mol·L-1。CO2(g)的平衡物质的量浓度c(CO2)与温度关系如下图所示。下列说法错误的是
CH3OH(g)+H2O(g),5 min后反应达到平衡时c(CH3OH)为0.2 mol·L-1。CO2(g)的平衡物质的量浓度c(CO2)与温度关系如下图所示。下列说法错误的是
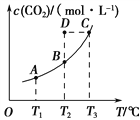
A. 0~5 min,CO2的平均反应速率为0.04 mol·L-1·min-1
B. 在T2 ℃时,若反应处于状态D,则v正<v逆
C. 反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的ΔH<0
CH3OH(g)+H2O(g)的ΔH<0
D. 若T1 ℃、T2 ℃时的平衡常数分别为K1、K2,则K1>K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从含碘废液(除H2O外,还含有CCl4、I2、I﹣等)中回收碘,其实验过程如图: 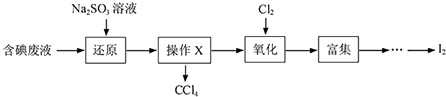
(1)Na2SO3溶液在空气中存放,容易被氧化成(填化学式).检验是否存在该杂质的方法是: .
(2)操作X的名称为 .
(3)通入Cl2发生反应的离子方程式 .
(4)含碘废液中加入稍过量的Na2SO3溶液,Na2SO3将废液中的I2还原为I﹣ , 这样做的目的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列常见物质的俗名与化学式对应正确的是
A.明矾——CuSO4·5H2OB.小苏打——NaHCO3
C.熟石灰——CaCl2D.大理石——BaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中X、Y、Z为单质,其他为化合物,它们之间存在如下转化关系(部分产物已略去)。其中,A俗称磁性氧化铁,E是不溶于水的酸性氧化物,能与氢氟酸反应。
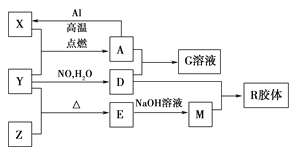
回答下列问题:
(1)组成单质Z的元素在周期表中的位置是________;M中存在的化学键类型为________;R的化学式是______________。
(2)一定条件下,Z与H2反应生成ZH4,ZH4的电子式为____________。
(3)已知A与1 mol Al反应转化为X时(所有物质均为固体),放出a kJ热量。写出该反应的热化学方程式:_____________________________________________________________。
(4)写出A和D的稀溶液反应生成G的离子方程式:__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com