
| A. | CH3CH(CH2CH3)2的系统命名为3-甲基戊烷,与CH3CH2CH(CH3)CH2CH3互为同系物 | |
| B. | 乙烯、氯乙烯和聚氯乙烯都能因发生加成反应而使溴水褪色 | |
| C. | 用甘氨酸(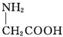 )和丙氨酸( )和丙氨酸(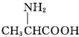 )的混合物在一定条件下可形成四种链状二肽 )的混合物在一定条件下可形成四种链状二肽 | |
| D. | 甲苯(C7H8)和甘油(C3H8O3)混合物,当总质量一定时,随$\frac{n({C}_{7}{H}_{8})}{n({C}_{3}{H}_{8}{O}_{3})}$比值增大,耗氧量和生成水的量都增大. |
分析 A.二者分子式相同、结构相同;
B.聚乙烯中不含碳碳不饱和键,没有烯烃性质;
C.氨基酸形成肽键原理为羧基提供-OH,氨基提供-H,两个氨基酸分子脱去一个水分子脱水结合形成二肽,既要考虑不同氨基酸分子间生成二肽,又要考虑同种氨基酸分子间形成二肽;
D.甲苯(C7H8)和甘油(C3H8O3)混合物,可以改写为C7H8、C3H2(H2O)3,质量相同时耗氧量与H原子个数和C原子个数比成正比,生成水的量与H元素含量成正比.
解答 解:A.二者分子式相同、结构相同,为同一物质,故A错误;
B.聚乙烯中不含碳碳不饱和键,没有烯烃性质,不能和溴水发生加成反应,故B错误;
C.氨基酸生成二肽,就是两个氨基酸分子脱去一个水分子,当同种氨基酸脱水,生成2种二肽;当是异种氨基酸脱水:可以是丙氨酸脱去羟基,甘氨酸脱氢;也可以甘氨酸脱羟基,丙氨酸脱去氢,生成2种二肽.所以共有4种,故C正确;
D.甲苯(C7H8)和甘油(C3H8O3)混合物,可以改写为C7H8、C3H2(H2O)3,质量相同时耗氧量与H原子个数和C原子个数比成正比,生成水的量与H元素含量成正比,所以随$\frac{n({C}_{7}{H}_{8})}{n({C}_{3}{H}_{8}{O}_{3})}$比值增大,耗氧量增大,但生成水的量减小,故D错误;
故选C.
点评 本题考查有机物结构和性质、化学方程式的有关计算等知识点,明确物质性质、官能团及其性质关系是解本题关键,难点是D选项计算.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
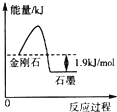 根据表中的信息判断下列说法错误的是( )
根据表中的信息判断下列说法错误的是( )| 物质 | 外观 | 燃烧热/(kJ•mol-1) |
| 金刚石 | 无色、透明固体 | 395.4 |
| 石墨 | 灰黑,不透明固体 | 393.5 |
| A. | 由表中信息可得如图所示的图象 | |
| B. | 由表中信息知C(石墨,s)=C(金刚石,s)△H=+1.9 kJ•mol-1 | |
| C. | 由表中信息可知相同条件下金刚石的熔点低于石墨的熔点 | |
| D. | 石墨燃烧热的热化学方程式为C(石墨,s)+$\frac{1}{2}$O2(g)═CO(g)△H=-393.5 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子.
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
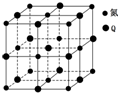 X、Y、Z、Q、R五种元素的原子序数依次增大.其中:X的最外层电子排布为nsnnp2n;Y是元素周期表中电负性最大的元素;Y、Z位于同一主族;Q基态原子核外的M能层中有两个未成对电子和三个空轨道;R位于第四周期ⅥB族.
X、Y、Z、Q、R五种元素的原子序数依次增大.其中:X的最外层电子排布为nsnnp2n;Y是元素周期表中电负性最大的元素;Y、Z位于同一主族;Q基态原子核外的M能层中有两个未成对电子和三个空轨道;R位于第四周期ⅥB族.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
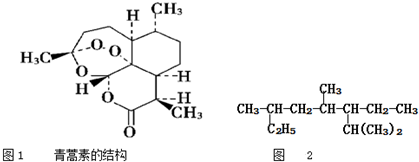
| A. | 下列物质的沸点按由低到高的顺序排列为CH3(CH2)2CH3<CH3(CH2)3CH3<(CH3)3CCH3<(CH3)2CHCH2CH3 | |
| B. | 青蒿素是抗疟疾特效药,结构如图1所示,有酯基、过氧键和醚键,不溶于水,易溶于氯仿、丙酮等,可以用乙醚从植物中提取,能够发生水解反应,具有强氧化性 | |
| C. | 油脂在一定条件下水解成高级脂肪酸和甘油,称为皂化反应 | |
| D. | 按系统命名法命名时,图2有机物的名称是3,5,7-三甲基-6-乙基辛烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
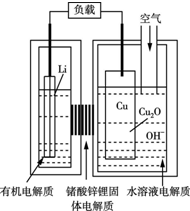 近年来科学家正在研制一种高容量、低成本锂-铜空气燃料电池.该电池通过一种复杂的铜腐蚀现象产生电力,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH─,下列说法不正确的是( )
近年来科学家正在研制一种高容量、低成本锂-铜空气燃料电池.该电池通过一种复杂的铜腐蚀现象产生电力,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH─,下列说法不正确的是( )| A. | 放电时,电子通过固体电解质向Cu极移动 | |
| B. | 通空气时,铜被腐蚀,表面产生Cu2O | |
| C. | 放电时,正极的电极反应式为Cu2O+H2O+2e─=2Cu+2OH─ | |
| D. | 整个反应过程中,铜相当于催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
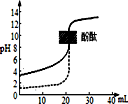
| A. | 反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)在室温下可自发进行,则该反应的△H<0 | |
| B. | 在铜的电解精炼过程中,若转移1mol电子,则阳极溶解32gCu | |
| C. | 常温下向CuS的悬浊液中加入饱和MnSO4溶液可生成MnS沉淀,则Ksp(MnS))<Ksp(CuS) | |
| D. | 常温下用0.1mol/LNaOH溶液分别滴定相同物质的量浓度和相同体积的盐酸和醋酸,其中实线(如图)表示的是滴定盐酸的曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | 0 | 20 | 40 | 60 | 80 | 100 | 120 |
| T1 | 2100 | 1052 | 540 | 199 | 8.7 | 0.06 | 0.06 |
| T2 | 2100 | 869 | 242 | x | x | x | x |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com