
| A. | Cl•在反应中是催化剂 | |
| B. | Cl•比Cl2更活泼 | |
| C. | ②也可能是Cl•(g)+CH4(g)→CH3Cl(g)+H•(g) | |
| D. | 由③可知C-Cl的键能比Cl-Cl的键能小 |
分析 A、Cl•在反应中是反应物;
B、Cl•最外层7个电子,而Cl2中各原子达8电子的稳定结构;
C、Cl•使甲烷分子中的碳氢键断裂,形成活泼的氢与氯原子结合生成氯化氢;
D、共价键键长越长键能越小.
解答 解:A、Cl•在反应中是反应物,而不是催化剂,故A错误;
B、Cl•最外层7个电子,而Cl2中各原子达8电子的稳定结构,所以Cl•比Cl2更活泼,故B正确;
C、Cl•使甲烷分子中的碳氢键断裂,形成活泼的氢与氯原子结合生成氯化氢,所以不可能是Cl•(g)+CH4(g)→CH3Cl(g)+H•(g),故C错误;
D、碳的原子半径小于氯原子,所以键长C-Cl<Cl-Cl,则键能C-Cl的键能比Cl-Cl的键能大,故D错误;
故选B.
点评 本题考查了化学反应机理,难度不大,根据总反应方程式结合图片即可判断物质的性质、结构,侧重于考查学生的分析能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
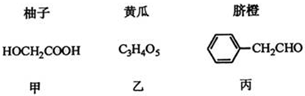
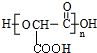 +(n-1)H2O.
+(n-1)H2O.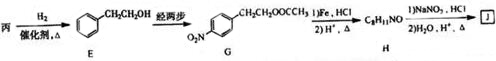
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
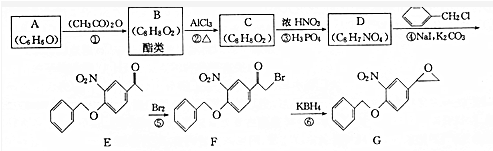
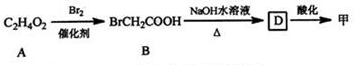
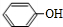 +(CH3CO)2O→
+(CH3CO)2O→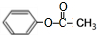 +CH3COOH.
+CH3COOH.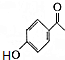 ;D的结构简式为
;D的结构简式为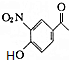 .
.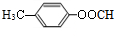 (填结构简式)
(填结构简式) 为起始原料制备
为起始原料制备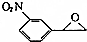 的合成路线:
的合成路线: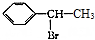 $→_{△}^{NaOH水溶液}$
$→_{△}^{NaOH水溶液}$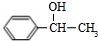 $→_{Cu/△}^{O_{2}}$
$→_{Cu/△}^{O_{2}}$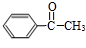 $→_{H_{3}PO_{4}}^{浓HNO_{3}}$
$→_{H_{3}PO_{4}}^{浓HNO_{3}}$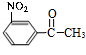 $\stackrel{NaBH_{4}}{→}$
$\stackrel{NaBH_{4}}{→}$ .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 自然界中存在大量的金属元素,其 中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用.
自然界中存在大量的金属元素,其 中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用.| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 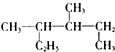 的系统命名是3,4-二甲基己烷 的系统命名是3,4-二甲基己烷 | |
| B. | 樱桃中含有一种羟基酸(如图所示)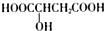 ,该羟基酸可以发生取代、氧化和缩聚等反应 ,该羟基酸可以发生取代、氧化和缩聚等反应 | |
| C. | 所有的糖、油脂、蛋白质都能水解,但水解产物不同 | |
| D. | 等质量的甲醛和乙酸充分燃烧耗氧量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A | 将浓硫酸和碳单质混合加热,直接将生成的气体通入足量的澄清石灰水,石灰水变浑浊 | 检验气体产物中CO2的存在 |
| B | 将NaOH的乙醇溶液加入溴乙烷中,加热,将产生的气体直接通入到酸性高锰酸钾溶液中,溶液褪色 | 证明溴乙烷的消去反应有乙烯生成 |
| C | 先滴入Ba(NO3)2溶液,产生沉淀,加入足量稀盐酸,仍有沉淀 | 检验溶液中是否含有SO42- |
| D | 常温下测定物质的量浓度相同的盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH | 证明相同条件下,在水中HCl电离程度大于CH3COOH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com