
| A. | BOH的电离方程式是BOH═B++OH- | |
| B. | 将一定体积的上述两种溶液混合后得到中性溶液,则V(HA)<V(BOH) | |
| C. | 在0.1 mol•L-1BA溶液中,c(B+)>c(A-)>c(OH-)>c(H+) | |
| D. | 若将0.1 mol•L-1BOH溶液稀释至0.001 mol•L-1,则溶液的pH=9 |
分析 25℃时,浓度均为0.1mol•L-1的HA溶液和BOH溶液,pH分别是1和11,HA中氢离子浓度等于酸浓度,所以是强酸,BOH中氢氧根离子浓度小于碱浓度,所以BOH是弱碱,根据酸碱的强弱及电离特点来分析解答.
解答 解:25℃时,浓度均为0.1mol•L-1的HA溶液和BOH溶液,pH分别是1和11,HA中氢离子浓度等于酸浓度,所以是强酸,BOH中氢氧根离子浓度小于碱浓度,所以BOH是弱碱,
A.BOH是弱碱,溶于水只有部分电离,溶液中存在电离平衡,所以其电离方程式是BOH?B++OH-,故A错误;
B.若一定量的上述两溶液混合,恰好中和时生成BA,BA是强酸弱碱盐,其溶液呈酸性,若使上述两种溶液混合后得到中性溶液,所需BOH的物质的量多于HA,其浓度相同,则V(HA)<V(BOH),故B正确;
C.BA是强酸弱碱盐,其溶液呈酸性,结合电荷守恒知,0.1 mol•L-1 BA溶液中,c(A-)>c(B+)>c(H+)>c(OH-),故C错误;
D.BOH是弱碱,溶液中存在电离平衡,将0.1mol•L-1 BOH溶液稀释至0.001mol•L-1,稀释过程中促进弱碱电离,所以溶液的pH>9,故D错误;
故选B.
点评 本题考查酸碱混合离子的浓度关系,明确信息中pH及离子的关系来判断酸碱的强弱是解答本题的关键,并熟悉电离、盐类水解等知识来解答,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
| A. | CH3CH2CH2Cl | B. | CH3CHBrCH(CH3)CH2Br | ||
| C. | CH3CHBrCH2CH2Br | D. | CH3CH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
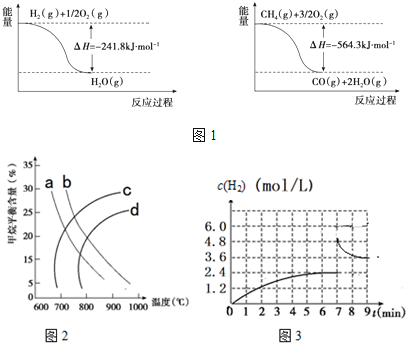
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
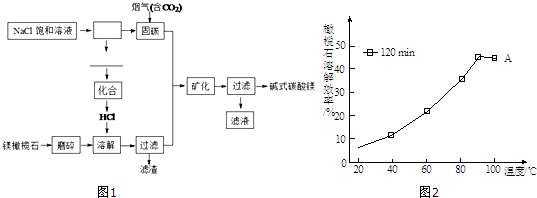
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 102 | 74 |
| 主要化合价 | +2 | +3 | +6、+4、-2 | -2 |
| A. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| B. | 气态氢化物的稳定性H2Z<H2W | |
| C. | X、Y元素的金属性X<Y | |
| D. | 一定条件下,Z单质与W的常见单质直接生成ZW3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
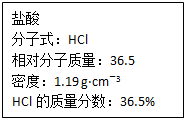 (1)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,其中O2的质量分数为27.6%.若其中CO和N2的物质的量之比为1:1,则混合气体中氧元素的质量分数为48.3%.
(1)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,其中O2的质量分数为27.6%.若其中CO和N2的物质的量之比为1:1,则混合气体中氧元素的质量分数为48.3%.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13C与15N具有相同的中子数 | B. | 13C与C60是同一种物质 | ||
| C. | 15N与14N互为同位素 | D. | 15N的核外电子数与中子数相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com