
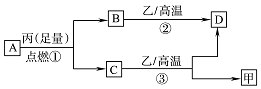
 已知X、Y、Z是三种原子序数依次增大的短周期元素.甲、乙、丙分别是三种元素形成的单质,A、B、C、D分别是由三种元素中的两种形成的化合物,且A与C中均含有10个电子.它们之间转化关系如图所示.下列说法正确的是( )
已知X、Y、Z是三种原子序数依次增大的短周期元素.甲、乙、丙分别是三种元素形成的单质,A、B、C、D分别是由三种元素中的两种形成的化合物,且A与C中均含有10个电子.它们之间转化关系如图所示.下列说法正确的是( )| A. | 原子半径:Z>Y>X | B. | 稳定性:A>C | ||
| C. | 反应②和③均为吸热反应 | D. | X、Y、Z可以形成离子化合物 |
分析 A与C中均含有10个电子,A燃烧可生成C,由转化关系可知A应为CH4,丙为O2,B为CO2,C为H2O,B、C都可与乙在高温下反应,乙应为C,则D为CO,甲为H2,则X为H元素,Y为C元素,Z为O元素,以此解答该题.
解答 解:由以上分析可知X为H元素,Y为C元素,Z为O元素,A为CH4,丙为O2,B为CO2,C为H2O,乙为C,D为CO,甲为H2,
A.同周期元素从左到右原子半径逐渐减小,应为C>O,故A错误;
B.非金属性O>C,元素的非金属性越强,对应的氢化物越稳定,故B错误;
C.反应②和③均为碳为还原剂的氧化还原反应,都为吸热反应,故C正确;
D.X为H元素,Y为C元素,Z为O元素,对应的化合物都为共价化合物,故D错误.
故选C.
点评 本题考查无机物的推断以及原子结构与元素周期律的综合应用,题目难度中等,A与C中均含有10个电子是推断突破口,再结合反应进行分析解答,对学生的逻辑推理有一定的要求,注意熟练掌握元素化合物知识,试题培养了学生的分析能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 大气雾霾污染现象的产生与汽车尾气排放有关 | |
| B. | 玻璃和氮化硅陶瓷都属于新型无机非金属材料 | |
| C. | 活性炭与二氧化硫都可用于漂白,其漂白原理相同 | |
| D. | 空气中的臭氧对人体健康有益无害 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1 367.0 kJ•mol-1(燃烧热) | |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+57.3 kJ•mol-1(中和热) | |
| C. | S(s)+O2(g)═SO2(g)△H=-296.8 kJ•mol-1(反应热) | |
| D. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=+110.5 kJ•mol-1(燃烧热) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
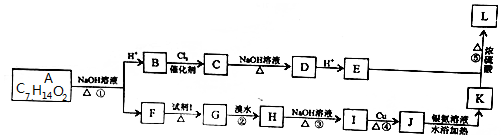
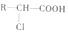
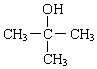 、
、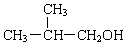 .
.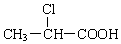 +2 NaOH$→_{△}^{水}$
+2 NaOH$→_{△}^{水}$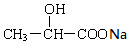 +NaOH+H2O.
+NaOH+H2O.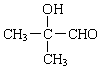 +2 Ag(NH3)2OH$\stackrel{△}{→}$
+2 Ag(NH3)2OH$\stackrel{△}{→}$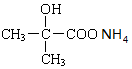 +2 Ag↓+3NH3+H2O.
+2 Ag↓+3NH3+H2O.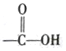
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | ① | ② | ③ | ④ |
| 科学家 | 纽兰兹 | 道尔顿 | 德贝莱纳 | 尚古尔多 |
| 工作 | 发现“八音律”,指出从某一指定的元素起,第八个元素是第一个元素的某种重复 | 创立 近代原子论,率先开始相对原子质量的测定工作 | 发现了5组性质相似的“三元素组”,中间元素的相对原子质量为前后两种元素相对原子质量的算术平均值 | 认为 各元素组之间并非毫不相关,可以用相对原子质量把它们按从小到大的顺序串联 |
 ,写出Z元素气态氢化物的电子式:
,写出Z元素气态氢化物的电子式: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
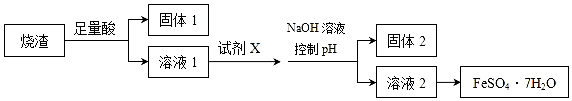
| A. | 溶液1中的阳离子可与NH4+、HCO3-、I-、SO42-在同一溶液中大量共存 | |
| B. | 向溶液2中加入3-5滴K3[Fe(CN)6](铁氰化钾)溶液,可观察到有蓝色沉淀生成 | |
| C. | 向固体2中加入足量NaOH溶液,发生反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O | |
| D. | 从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化和分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 化学键 | H-H | C-H | C-C | C=C |
| 键能(kJ•mol-1) | 436 | 413 | 348 | 612 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
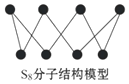
| A. | S2、S4、S6、S8互为同位素 | |
| B. | S2的摩尔质量为32 g/mol | |
| C. | 硫的单质在足量的空气中完全燃烧可生成SO3 | |
| D. | 1 mol S8单质中含有的S-S键个数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com