
| A. | C原子的轨道表示式: | |
| B. | N原子轨道表示式: | |
| C. | Cr基态原子核外电子排布式:[Ar]3d54s1 | |
| D. | Ca原子的电子排布式:[Ar]3d2 |
分析 A.根据原子核外电子排布原则:电子优先单独占据1个轨道,且自旋方向相同;
B.根据原子核外电子排布原则:电子优先单独占据1个轨道,且自旋方向相同;
C.Cr原子的核外有24个电子,分4层排布;
D.Ca原子的核外有20个电子,分4层排布,最外层为4s轨道.
解答 解:A.电子优先单独占据1个轨道,且自旋方向相同,则C原子的轨道表示式:
 ,故A错误;
,故A错误;
B.电子优先单独占据1个轨道,且自旋方向相同,N原子核外有7个电子,分2层排布,原子的轨道表示式: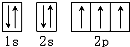 ,故B错误;
,故B错误;
C.Cr原子的核外有24个电子,分4层排布,Cr基态原子核外电子排布式:[Ar]3d54s1,故C正确;
D.Ca原子的核外有20个电子,分4层排布,最外层为4s轨道,Ca原子的电子排布式:[Ar]4s2,故D错误.
故选C.
点评 本题考查原子核外电子排布,明确轨道式和电子排布式的区别是解答本题的关键,注意洪特规则的应用,题目难度不大.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:l | B. | 2:2:1 | C. | 2:3:l | D. | 4:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | |
| B. | 向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | 冷的氢氧化钠溶液中通入氯气:Cl2+2OH-═ClO-+Cl-+H2O | |
| D. | 明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-═2 BaSO4↓+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑦ | B. | ③⑥⑦ | C. | ④⑤⑥ | D. | ①②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L | B. | 0.5L | C. | 0.3L | D. | 0.6L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
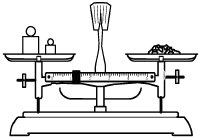 | 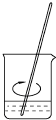 | 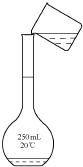 | 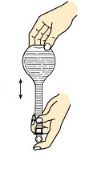 |
| A.称量 | B.溶解 | C.转移 | D.摇匀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com