
����Ŀ����Ҫ����գ�
��.�û�ѧ����ش��������⣺
��1��д��������̼���ӵĵ���ʽ��___________��
��2��д���������ӵĽṹʽ___________��
��3��A+��B����C��D ��������(���ӻ�����)�����Ƕ��ֱ�10�����ӣ���֪����������ת����ϵ��A++B��![]() C+D������A+�ĵ���ʽ��_____________���Ƚ�C��D���ȶ��Ե�ǿ����_____________________���û�ѧʽ��ʾ����
C+D������A+�ĵ���ʽ��_____________���Ƚ�C��D���ȶ��Ե�ǿ����_____________________���û�ѧʽ��ʾ����
��4���õ���ʽ��ʾMgCl2���γɹ���__________________________________��
��.�������ʣ��� N2 �� CO2 �� NH3 �� Na2O ��Na2O2 �� NaOH �� CaBr2 �� H2O2 �� NH4Cl �� Ar��
��1���Ⱥ��м��Լ��ֺ��зǼ��Լ�����_______��������ţ���ͬ��
��2�����зǼ��Լ������ӻ�������_____��
��3��������ѧ������_____��
�����б仯�У��� �ɱ������� �� ������ۻ��� �� KHSO4���ڣ� �� ��������ˮ��
�� ��������ˮ���� HI�ֽ⣻ �� �������� �� ��������ľ̿������
��1��δ�ƻ���ѧ������___________��
��2�������Ӽ����ƻ�����_________��
��3�������ۼ����ƻ�����_________��
��.�������ʣ��� 1H��2H��3H �� �� H2O��D2O��T2O�� �� O2��O3�� �� 14N��14C
��1����Ϊͬλ�ص��ǣ�______��
��2����Ϊͬ����������ǣ�______��
��3���������ԭ��1H��2H��3H ���ȵ�����ԭ��35Cl��37Cl����Ϊ�Ȼ��⣬�ɵ÷�������Է���������ͬ����________�֡�
���𰸡� ![]() N��N
N��N 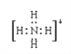 H2O>NH3
H2O>NH3 ![]() �� �� �� �� �� �� �� �� �� �� �� �� �� 5
�� �� �� �� �� �� �� �� �� �� �� �� �� 5
��������I.���黯ѧ�����ʹ�ã��Լ�10����������1��CO2������C��O����2�����Ӷԣ������ʽΪ![]() ����2��N2������Nԭ�ӹ�����������ṹʽΪN��N ����3��������Ϊ10e��������A����B��
����2��N2������Nԭ�ӹ�����������ṹʽΪN��N ����3��������Ϊ10e��������A����B��![]() C+D�����Ƴ�DΪNH3����A��ΪNH4����BΪOH����CΪH2O��NH4���ĵ���ʽΪ
C+D�����Ƴ�DΪNH3����A��ΪNH4����BΪOH����CΪH2O��NH4���ĵ���ʽΪ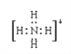 ���Ƚ��⻯����ȶ��ԣ���Ҫ�ȽϷǽ����ԣ��ǽ�����Խǿ������̬�⻯��Խ�ȶ���O�ķǽ�����ǿ��N�����H2O��NH3�ȶ�����4���Ȼ�þΪ���ӻ�����õ���ʽ��ʾ���γɹ���Ϊ
���Ƚ��⻯����ȶ��ԣ���Ҫ�ȽϷǽ����ԣ��ǽ�����Խǿ������̬�⻯��Խ�ȶ���O�ķǽ�����ǿ��N�����H2O��NH3�ȶ�����4���Ȼ�þΪ���ӻ�����õ���ʽ��ʾ���γɹ���Ϊ![]() ��II.���黯ѧ����������𣬢�N2ֻ���Ǽ��Լ�����CO2�Ǻ��м��Լ��ķǼ��Է��ӣ���Na2Oֻ�����Ӽ������ӻ������Na2O2�Ǻ������Ӽ����Ǽ��Թ��ۼ������ӻ������NaOH�Ǻ������Ӽ������Թ��ۼ������ӻ������CaBr2�������Ӽ������ӻ������H2O2�Ǻ��м��Լ��ͷǼ��Լ��Ĺ��ۻ������NH4Cl�Ǻ������Ӽ��ͼ��Թ��ۼ������ӻ������Ar�����л�ѧ������1���Ⱥ��м��Լ��ֺ��зǼ��Լ�����H2O2�����ࣻ��2�����зǼ��Լ������ӻ������Ǣݣ���3��������ѧ�����Ǣ⣻III.���黯ѧ�������ʵı仯���ٸɱ��������ƻ����Ƿ��Ӽ�����������������ۻ��������Ϊ���ӻ�����ۻ�ʱ�ƻ����Ӽ�����KHSO4�ۻ���KHSO4Ϊ���ӻ�����ۻ�ʱ�ƻ����Ӽ�������������ˮ���������ڹ��ۻ��������ˮ�����H����SO42�����ƻ����ۼ�������������ˮ���ƻ����Ӽ�����������HI�ֽ��H2��I2���ƻ����ۼ����ߵⵥ���������ƻ����Ӽ�������������������ľ̿�������ƻ����Ƿ��Ӽ�����������1��δ�ƻ���ѧ�����Ǣ٢ݢߢࣻ��2�����ƻ����Ӽ����Ǣڢۣ���3�����ƻ����ۼ����Ǣܢޣ�IV.����ͬλ�ء�ͬ�������塢���أ���1��ͬλ���о���Χԭ�ӣ���������������ͬ����������ͬ��ͬһԪ�ز�ͬԭ�ӣ�����Ϊͬλ�ص��Ǣ٣���2��ͬ���������о��Ķ����ʣ���ͬ��Ԫ�ز�ͬ�ṹ�ĵ��ʣ���Ϊͬλ�ص��Ǣۣ���3��������ԭ�Ӻ�������ԭ����ɵ��Ȼ��⣬���������ڽ������ԭ����������˹����Ȼ�������ԭ�������ֱ���36��38��37��39��40���������֡�
��II.���黯ѧ����������𣬢�N2ֻ���Ǽ��Լ�����CO2�Ǻ��м��Լ��ķǼ��Է��ӣ���Na2Oֻ�����Ӽ������ӻ������Na2O2�Ǻ������Ӽ����Ǽ��Թ��ۼ������ӻ������NaOH�Ǻ������Ӽ������Թ��ۼ������ӻ������CaBr2�������Ӽ������ӻ������H2O2�Ǻ��м��Լ��ͷǼ��Լ��Ĺ��ۻ������NH4Cl�Ǻ������Ӽ��ͼ��Թ��ۼ������ӻ������Ar�����л�ѧ������1���Ⱥ��м��Լ��ֺ��зǼ��Լ�����H2O2�����ࣻ��2�����зǼ��Լ������ӻ������Ǣݣ���3��������ѧ�����Ǣ⣻III.���黯ѧ�������ʵı仯���ٸɱ��������ƻ����Ƿ��Ӽ�����������������ۻ��������Ϊ���ӻ�����ۻ�ʱ�ƻ����Ӽ�����KHSO4�ۻ���KHSO4Ϊ���ӻ�����ۻ�ʱ�ƻ����Ӽ�������������ˮ���������ڹ��ۻ��������ˮ�����H����SO42�����ƻ����ۼ�������������ˮ���ƻ����Ӽ�����������HI�ֽ��H2��I2���ƻ����ۼ����ߵⵥ���������ƻ����Ӽ�������������������ľ̿�������ƻ����Ƿ��Ӽ�����������1��δ�ƻ���ѧ�����Ǣ٢ݢߢࣻ��2�����ƻ����Ӽ����Ǣڢۣ���3�����ƻ����ۼ����Ǣܢޣ�IV.����ͬλ�ء�ͬ�������塢���أ���1��ͬλ���о���Χԭ�ӣ���������������ͬ����������ͬ��ͬһԪ�ز�ͬԭ�ӣ�����Ϊͬλ�ص��Ǣ٣���2��ͬ���������о��Ķ����ʣ���ͬ��Ԫ�ز�ͬ�ṹ�ĵ��ʣ���Ϊͬλ�ص��Ǣۣ���3��������ԭ�Ӻ�������ԭ����ɵ��Ȼ��⣬���������ڽ������ԭ����������˹����Ȼ�������ԭ�������ֱ���36��38��37��39��40���������֡�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���ijһԪ��HA��NaOH��Һ�������ϣ�������Һ��Ũ�Ⱥͻ�Ϻ�������Һ��pH�����ʾ��
ʵ���� | HA���ʵ���Ũ�ȣ�mol*L��1�� | NaOH���ʵ���Ũ�ȣ�mol*L��1�� | �����Һ��pH |
�� | 0.1 | 0.1 | pH=9 |
�� | c | 0.2 | pH=7 |
�� | 0.2 | 0.1 | pH��7 |
��ش�
��1���Ӣ������������HA�����ǿ�ᡱ�����ᡱ����
��2���������������c0.2��ѡ����ڡ�����С�ڡ����ڡ��������Һ������Ũ��c��A������c��Na+���Ĵ�С��ϵ�� ��
��3���Ӣ���ʵ����������˵��HA�ĵ���̶�NaA��ˮ��̶ȣ�ѡ����ڡ�����С�ڡ����ڡ������û����Һ������Ũ���ɴ�С��˳���� ��
��4������ʵ�����û����Һ����ˮ�������c��OH��������Һ�е�c��OH����֮��Ϊ �� д���û����Һ��������ʽ�ľ�ȷ��������ܽ��Ƽ��㣩��c��Na+����c��A����=molL��1 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£��� 0.1000molL��1NaOH��Һ�ζ� 20.00mL0.1000molL��1CH3COOH��Һ���õζ�������ͼ������˵����ȷ���ǣ� �� 
A.�����ʾ��Һ�У�c��CH3COO����+c��OH����=c��CH3COOH��+c��H+��
B.�����ʾ��Һ�У�c��Na+��=c��CH3COOH��+c��CH3COO����
C.�����ʾ��Һ�У�c��Na+����c��OH������c��CH3COO������c��H+��
D.�ζ������п��ܳ��֣�c��CH3COOH����c��CH3COO������c��H+����c��Na+����c��OH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�����������������ȷ���ǣ� ��
A.���³�ѹ�£�22.4 L NO2�к���NA������
B.1 mol�ǻ��е�����Ϊ10 NA
C.R2+��������ΪA��������ΪN����n g R�ü�̬���������к�������Ϊ ![]() ��A��N+8��NA
��A��N+8��NA
D.�ڷ�ӦKIO3+6HI�TKI+3I2+3H2O�У�ÿ����3 mol I2ת�Ƶĵ�����Ϊ6 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£�ͨ�����з�Ӧ��ʵ��ȼú��������Ļ��գ�SO2��g��+2CO��g�� ![]() 2CO2��g��+S��l����H��0����Ӧ�ں��ݵ��ܱ������н��У������й�˵����ȷ���ǣ� ��
2CO2��g��+S��l����H��0����Ӧ�ں��ݵ��ܱ������н��У������й�˵����ȷ���ǣ� ��
A.ƽ��ǰ�����ŷ�Ӧ�Ľ��У�������ѹǿʼ�ղ���
B.ƽ��ʱ�������������䣬�����������Ӧ���ʼӿ�
C.ƽ��ʱ�������������䣬�����¶ȿ����SO2��ת����
D.�����������䣬ʹ�ò�ͬ�������÷�Ӧƽ�ⳣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�������ƿ����ʹ�÷�������������ȷ����
��������һ�����ʵ�����Ũ�ȵ���Һ��ר������
��ʹ��ǰҪ�ȼ������ƿ�Ƿ�©Һ ������ƿ������������
�ܲ���������ƿ�������ƺõ���Һ �ݿ�����400mL����ƿ����250mL��Һ
A. �ٺ͢� B. �ٺ͢� C. ���ˢ� D. ���ˢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ������þ�����������ڲ�ͬ�¶��·�Ӧ��̽����������Է�Ӧ���ʵ�Ӱ�죮����ʵ���ñ����£�
ʵ�� | �¶�/K | ����Ũ�� | ����Ũ��/molL��1 | ʵ��Ŀ�� |
�� | 298 | 0.20 | a��ʵ��ٺ͢ڣ�̽���¶ȶԷ�Ӧ���ʵ�Ӱ�죻 | |
�� | 308 | 0.20 | ||
�� | 298 | 0.40 | ||
�� | 0.20 | |||
�� | 0.20 |
��1��������Ϲ���������дʵ��ܢݵĿո�
��2���ϱ�ʵ����У�þ����ʧ��ʱ��Ϊ20s��ʵ������У�þ��ʣ��������ʱ���ϵ��ͼ��
����跴Ӧ����������������䣬��Ҫ����÷�Ӧ������v��HCl������ȱ�ٵ������� ��
��3��������Ӧ�¶�ÿ����10�棬��Ӧ��������ԭ����2�����¶���ͬʱ����������ͬŨ������ƽ���ٶȵ�1/2������ͼ�д��»�����ʵ��ڡ�����ʵ����д���ʵ�顱��þ��������ʱ���ϵ���ߣ����âڻ��ע�����ߴ�����ʵ�飨����ʵ��������þ��ȫ��ͬ����þ������ȫ�ܽ⣩��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˷���״������ᡢ�������ӵĻ����������������ʵ����̣�������������д����ʱ���ò�����������д���������й����ʵĽṹ��ʽ��
д���������ʵĽṹ��ʽA________��C________��E________��G________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪25��ʱ�й�����ĵ���ƽ�ⳣ����
���ữѧʽ | CH3COOH | HCN | H2CO3 |
����ƽ�ⳣ����25�棩 | 1.8��10��5 | 4.9��10��10 | K1=4.3��10��7 |
�������й�˵����ȷ���ǣ� ��
A.�����ʵ���Ũ�ȵĸ���ҺpH��ϵΪ��pH��NaCN����pH��Ma2CO3����pH��CH3COONa��
B.amol/L HCN ��Һ��b mol/L NaOH��Һ�������Ϻ�������Һ��c��Na+����c��CN��������һ��a����b
C.����������μ�ˮ������Һ�ĵ����ԡ�����ĵ��루�̣��ȡ�c��H+������������С
D.NaHCO3��Na2CO3�Ļ����Һ�У�һ�����ڣ�c��Na+��+c��H+��=c��OH����+c��HCO3����+2c��CO ![]() ��
��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com