
下列化学用语中,表示正确的是
A.2s的电子云模型是: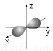
B.肽键的结构式为: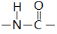
C.H2S分子的球棍模型为:
D.最外层电子排布式为ns2np3对应的轨道表示式为: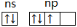
科目:高中化学 来源:2013-2014学年北京顺义区高三第二次统练理综化学试卷(解析版) 题型:填空题
利用工业炼铜后的炉渣(含Fe2O3、FeO、SiO2、Al2O3),制备无机高分子絮凝剂聚合氯化铝和净水剂高铁酸钠(Na2FeO4)。其工艺流程如下(部分操作和条件略):
Ⅰ.用稀盐酸浸取炉渣,过滤;
Ⅱ.向滤液中加入过量NaClO溶液,调pH约为3,过滤;
Ⅲ.溶液进行减压蒸发等操作,甩干后送入聚合炉中进行高温聚合,……得到聚合氯化铝。
Ⅳ.将Ⅱ中得到沉淀洗涤、干燥,再与NaClO和NaOH反应,生成高铁酸钠。
(1)稀盐酸溶解Fe2O3的离子方程式是 。
(2)验证炉渣中含有FeO必要的化学试剂为 。
(3)已知:生成氢氧化物沉淀的pH
物质 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
开始沉淀时 | 1.5 | 3.4 | 6.3 |
完全沉淀时 | 2.8 | 4.7 | 8.3 |
①步骤Ⅱ中加入过量NaClO,反应的离子方程式是 。
②根据表中数据解释步骤Ⅱ中,调pH约为3的目的是 。
(4)该工业流程存在缺点,在步骤Ⅱ伴随着有氯气产生,此反应方程式是 。
(5)步骤Ⅲ中在减压蒸发与甩干操作之间,还需进行的操作是 。
(6)在步骤Ⅳ中,若该反应生成166 g Na2FeO4转移3 mol电子,则参加反应的还原剂和氧化剂的物质的量之比是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市丰台区高三下学期统一练习(一)化学试卷(解析版) 题型:选择题
下列解释事实的方程式表达不正确的是
A.碳酸氢钠可作食品膨松剂:2NaHCO3 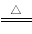 Na2CO3+ CO2↑+H2O
Na2CO3+ CO2↑+H2O
B.铝制容器不能盛装碱液:2Al +2OH-+2H2O = 2AlO2-+ 3H2↑
C.氯气可用于消毒:Cl2+H2O = 2H++ Cl-+ClO-
D.过氧化钠可用于呼吸面具:2Na2O2 + 2CO2 = 2 Na2CO3 + O2
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市闵行区高三二模化学试卷(解析版) 题型:选择题
常温下Ca(OH)2溶于水达到饱和时存在如下平衡:Ca(OH)2(s) Ca2++2OH-,饱和石灰水的密度为d g/cm3,溶液pH=12。下列有关叙述中,不正确的是
Ca2++2OH-,饱和石灰水的密度为d g/cm3,溶液pH=12。下列有关叙述中,不正确的是
A.加热至50℃,溶液的Ca2+的浓度增大
B.该温度下Ca(OH)2的溶解度为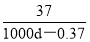 (g/100gH2O)
(g/100gH2O)
C.该饱和石灰水中,水电离出的OH-的浓度为10-12mol/L
D.加入生石灰并恢复至常温后,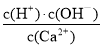 值不变
值不变
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市闵行区高三二模化学试卷(解析版) 题型:选择题
针对下图装置的说法中,正确是
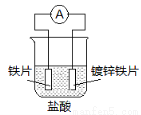
A.溶液中pH值明显下降
B.铁片为正极,镀锌铁片为负极
C.阴极的电极反应式:Fe-2e→Fe2+
D.电子由锌经溶液流向铁
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市徐汇、松江、金山三区高三二模化学试卷(解析版) 题型:填空题
为了回收利用钢铁生产过程中产生的SO2,工业上采用软锰矿(主要成分MnO2)脱硫同时制取硫酸锰技术,其流程示意图如下:
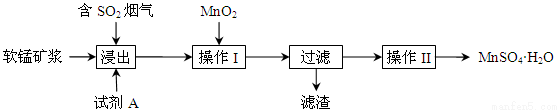
已知:浸出液的pH接近4,其中的金属离子主要是Mn2+,还含有少量的Fe2+。完成下列填空。
(1)写出浸出过程中主要反应的化学方程式: 。
(2)浸出过程的副反应之一是部分SO2被氧化为硫酸,致使浸出液的pH下降,这将 (“有利”、“不利”)于软锰矿浆继续吸收SO2。欲消除生成的硫酸,试剂A最好是 。
a.MnCO3 b.MnO2 c.CaO d.CaCO3
(3)操作I的目的是除去浸出液中的Fe2+,MnO2在氧化Fe2+的同时还 ,使Fe3+沉淀。检验过滤后溶液中是否含有Fe3+的操作是 。
(4)已知大于27℃时,MnSO4·H2O溶解度随温度上升而明显下降,则操作II的过程为: 、 、洗涤、干燥。工业上为了充分利用锰元素,在流程中 可循环使用。
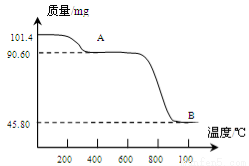
(5)通过煅烧MnSO4·H2O 可制得生产软磁铁氧体材料的MnxO4,如图是煅烧MnSO4·H2O时温度与剩余固体质量变化曲线。该曲线中A段所表示物质的化学式为 ;MnxO4中x= 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市徐汇、松江、金山三区高三二模化学试卷(解析版) 题型:选择题
如图是工业制纯碱的部分物质转化示意图,下列推测错误的是
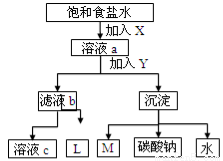
A.若是联碱法,溶液c可在转化流程中循环利用
B.若是氨碱法,则L的主要成分是NaCl
C.M可在转化流程中循环利用
D.X是NH3 ,Y是CO2
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市徐汇、松江、金山三区高三二模化学试卷(解析版) 题型:选择题
吸进人体内的氧有2%转化为加速人体衰老的氧化性极强的活性氧,若Na2SeO3能清除人体内活性氧,则Na2SeO3的作用是
A.还原剂 B.氧化剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市河西区高三总复习质量检测二理综化学试卷(解析版) 题型:填空题
(14分)工业上以乙苯为原料生产苯乙烯的反应如下(Ph代表苯基):
Ph—CH2CH3(g) Ph—CH=CH2(g)+H2(g) △H
Ph—CH=CH2(g)+H2(g) △H
某研究小组为探究温度等因素对该反应的产率影响,在容积可变的密闭容器中分别作了四组实验,实验结果如下图a、b所示。
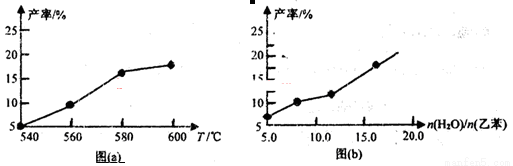
(1)根据反应及上图(a),判断△H 0(填“<”“=”或“>”,下同),△S 0;请选择经济、且适宜的反应温度: 。
(2)下列事实可以说明该反应已达平衡的是 。
A.混合气体的密度不再变化
B.氢气的体积分数保持不变
C.氢气、苯乙烯的生成速率之比保持不变
D.单位时间内消耗的n(乙苯)等于生成的n(H2)
(3)从压强因素分析,为提高乙苯的转化率,应采用 的生产条件。实际工业生产中常采用通入水蒸气的方法。水蒸气的含量对反应的影响结果如上图(b)所示。
①在做这四组实验时,应该采用的其他实验条件是 。
A.反应温度相同 B.采用不同的催化剂
C.压强都控制在常压下 D.反应相同时间时测定实验数据
②图(b)表明: 。
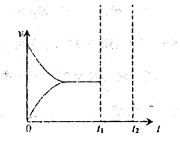
③一定温度下,在恒压密闭容器中,通入一定量n(H2O)/n(乙苯)=7:1的气体,发生上述反应,在t1时刻达到平衡。保持其他条件不变,此时分离出一定量的水蒸气,在t2时刻重新达到平衡,请在右图中画如反应再次达到平衡过程的图像。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com