
����Ŀ��Ϊ��ʵ����ˮ���Ρ���ij�������ۺϴ�����NH4+��ˮ��ҵ��������Ҫ��N2��CO2��SO2��NO��CO�������������ɷ֣����������ͼ���̣� 
��1������I����Ҫ�ɷ�Ϊ �� ������������������Ҫ�� ��
��2��������NH4+��ˮʱ��������Ӧ�����ӷ���ʽΪ ��
��3����XΪ�����������ϸ���ƿ���������ԭ���� ��
��4����ҵ�����е�SO2��NO���ɲ���NaClO2��Һ��Ϊ���ռ����о������ڹ��ݷ�Ӧ����ͨ�뺬��SO2��NO����������Ӧ�¶�Ϊ323K��NaClO2��ҺŨ��Ϊ5��10��3molL��1 �� ��Ӧһ��ʱ�����Һ������Ũ�ȵķ�����������
���� | SO42�� | SO32�� | NO3�� | NO2�� | Cl�� |
c��molL��1�� | 8.35��10��4 | 6.87��10��6 | 1.5��10��4 | 1.2��10��5 | 3.4��10��3 |
��д��NaClO2��Һ������������Ҫ��Ӧ�����ӷ���ʽ ��
����ѹǿ��NO��ת���������ߡ��������䡱���͡�����
���������շ�Ӧ�Ľ��У����ռ���Һ��pH��������������䡱��С������
���������NaClO��Ca��ClO��2���NaClO2 �� Ҳ�ܵõ��Ϻõ���������Ч�����ӻ�ѧƽ��ԭ��������Ca��ClO��2���NaClO���е��ŵ��� ��
���𰸡�
��1��CaCO3��CaSO3��Ca��OH��2��CO
��2��NH4++NO2��=N2��+2H2O
��3�����������ὫNO������NO3�� �� ����NH4+������Ӧ
��4��3ClO2��+4NO+4OH��=4NO3��+3Cl��+2H2O����ߣ���С��Ca2+��SO42���������CaSO4������ʹƽ������﷽���ƶ���SO2ת�������
���������⣺��1��������������֪����I����Ҫ�ɷ�ΪCaCO3��CaSO3��Ca��OH��2 �� ������������������Ҫ��CO�����Դ��ǣ�CaCO3��CaSO3��Ca��OH��2��CO����2��������NH4+��ˮʱ��������Ӧ�����ӷ���ʽΪNH4++NO2��=N2��+2H2O�����Դ��ǣ�NH4++NO2��=N2��+2H2O����3����XΪ�����������ϸ���ƿ���������ԭ���ǹ��������ὫNO������NO3�� �� ����NH4+������Ӧ�� ���Դ��ǣ����������ὫNO������NO3�� �� ����NH4+������Ӧ����4�����������ƾ��������ԣ���NaClO2��Һ�ʼ��ԣ���NaClO2��Һ������������Ҫ��Ӧ�����ӷ���ʽΪ3ClO2��+4NO+4OH��=4NO3��+3Cl��+2H2O������Ӧ�������С�ģ�������ѹǿ��NO��ת������ߣ�
���Դ��ǣ�3ClO2��+4NO+4OH��=4NO3��+3Cl��+2H2O����ߣ��ڸ��ݷ�Ӧ�ķ���ʽ3ClO2��+4NO+4OH��=4NO3��+3Cl��+2H2O��֪�������շ�Ӧ�Ľ������������ӱ����ģ����ռ���Һ��pH���ͣ�
���Դ��ǣ���С����4NO+3ClO2��+4OH��=4NO3��+3Cl��+2H2O����2�֣�2H2O+3ClO2��+4NO=4NO3��+3Cl��+4H+Ҳ���֣���ߣ�1�֣� �ڼ�С��1�֣��۴ӻ�ѧƽ��ԭ��������Ca��ClO��2���NaClO���е��ŵ���Ca2+��SO42���������CaSO4������ʹƽ������﷽���ƶ���SO2ת������ߣ�
���Դ��ǣ�Ca2+��SO42���������CaSO4������ʹƽ������﷽���ƶ���SO2ת������ߣ�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ǹ��ڷ�ӦA2��g��+3B2��g��2C��g��������ӦΪ���ȷ�Ӧ����ƽ���ƶ�ͼ��Ӱ��ƽ���ƶ���ԭ������ǣ� �� 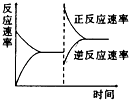
A.�����¶ȣ�ͬʱ��ѹ
B.�����¶ȣ�ͬʱ��ѹ
C.����Ӧ��Ũ�ȣ�ͬʱ��С������Ũ��
D.����Ӧ��Ũ�ȣ�ͬʱʹ�ô���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦA������+aB��g��C��g��+2D��g����aΪ������������Ӧ�����У���������������ʱ��C�İٷֺ�����C%�����¶ȣ�T����ѹǿ��P���Ĺ�ϵ��ͼ��ʾ������˵������ȷ���ǣ� �� 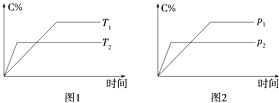
A.��a=2����AΪҺ̬�����
B.�÷�Ӧ������ӦΪ���ȷ�Ӧ
C.T2��T1 �� P2��P1
D.�����������䣬����B�����ʵ�����ƽ�������ƶ���ƽ�ⳣ��K����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܹ��ü��ܵĴ�С��Ϊ��Ҫ���������͵���( )
A.���³�ѹ�£���������̬�����嵥�ʳ�Һ̬
B.�����ǻӷ����ᣬ�����ᡢ�����Dz��ӷ�����
C.ϡ������һ�����Է�����ѧ��Ӧ
D.�����е����Ļ�ѧ���ʱ������ȶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪij��ѧ��Ӧ��������ʱ��Ĺ�ϵʾ��ͼ����t1ʱ�������¶Ȼ�����ѹǿ�����ʵı仯������ʾ��ͼ�ķ�Ӧ�ǣ� ��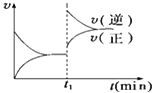
A.2SO2��g��+O2��g��2SO3��g����H��0
B.4NH3��g��+5O2��g��4NO��g��+6H2O��g����H��0
C.H2��g��+I2��g��2HI��g����H��0
D.2A��g��+B��g��2C��g����H��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵������ȷ����
A. ����̼̼���ǽ���C��C��C=C֮���һ������ۼ�
B. ���顢��ϩ����ʹ����KMnO4��Һ��ɫ
C. ��������Һ�м���������Һ��ˮԡ��������������
D. ҽ�þƾ���ʹ�����ʱ��ԣ�����������ɱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С��������CuO��NH3��Ӧ���о�NH3��ij�����ʲ��ⶨ����ɣ����������ʵ��װ�ã��г�װ��δ����������ʵ�飮��ش��������⣺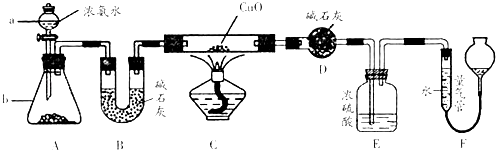
��1������a������Ϊ������b�п�ѡ����Լ�Ϊ ��
��2��ʵ�����У�����װ��A��������ȡ����ɫ������ ������ĸ����
A.Cl2
B.O2
C.CO2
D.NO2
��3��ʵ���й۲쵽װ��C�к�ɫCuO��ĩ��Ϊ��ɫ���壬����������ɫ��ζ�����壬��������֤��NH3�����ԣ�д����Ӧ�Ļ�ѧ����ʽ
��4��Eװ����Ũ��������� ��
��5����ȡ�������ǰ��Ӧ��װ��F���еIJ�����
��6��ʵ����ϣ�����ø����D����mg��װ��F�����������ΪnL��������ɱ�״�����������е������ԭ�Ӹ�����Ϊ���ú�m��n��ĸ�Ĵ���ʽ��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��50mL 0.50mol/L�����50mL 0.55mol/L NaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ��㷴Ӧ�ȣ� 
��1���ձ���������ĭ���ϵ���������
��2����ͼ��ʾ������A������������ʵ������У���������¶ȼ��ϵ�����ˮ��ϴ�ɾ�ֱ�Ӳ���NaOH��Һ���¶ȣ����õġ�H��57.3KJ/mol�����������������=������
��3��������ϡǿ�ᡢϡǿ�Ӧ����1molˮʱ�ų�57.3kJ��������д��ϡ�����ϡ����������Һ��Ӧ���к��ȵ��Ȼ�ѧ��ʽ��
��4������ͬŨ�Ⱥ�����İ�ˮ����NaOH��Һ��������ʵ�飬��õ��к��ȵ���ֵ�������ƫ����ƫС��������Ӱ�족��
��5��Ϊ�˲���ij��Ӧ���к��ȣ�����ʱ������Ҫ��������
�����Ũ�Ⱥ���� �ڼ��Ũ�Ⱥ���� �۱����� �ܷ�Ӧ����Һ������ ������ˮ�����ʵ��� ��Ӧǰ���¶ȱ仯�߲��������ʱ��
A.�٢ڢۢ�
B.�٢ۢܢ�
C.�ۢܢݢ�
D.ȫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��4.8 g O2��0.2 mol CO2��O2�����ʵ�����______mol�����ǵ����ʵ���֮����________��CO2��������_______g������֮����________����ͬ��ͬѹ�µ����֮����________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com