
| A. | 原溶液的浓度为0.1mol/L | B. | 反应后溶液中c(Fe3+)=0.1mol/L | ||
| C. | 反应后溶液中c(Fe3+)=c(Fe2+) | D. | 原溶液中c(Br-)=0.4mol/L |
分析 还原性Fe2+>Br-,所以FeBr2溶液中通入Cl2,Cl2先将Fe2+氧化为Fe3+,Fe2+反应完毕,若Cl2有剩余,剩余Cl2再将Br-氧化为Br2,最后溶液中含有Br-,说明Cl2完全反应,转化为Cl-.1.12L(标态下)Cl2的物质的量为0.05mol,根据氯元素守恒可知n(Cl-)=0.1mol,则溶液中n(Br-)=3n(Cl-)=0.3mol;若溶液中Br-参加反应,令溶液中FeBr2物质的量为xmol,则根据电子转移守恒,x+(2x-0.3)=0.1,解得x=$\frac{2}{15}$mol,$\frac{2}{15}$molFe2+的提供电子为$\frac{2}{15}$mol大于0.05molCl2能够获得电子0.1mol,且(2x-0.3)<0,不符合题意;若溶液中Br-未参加反应,则原溶液中的Fe2+物质的量为0.15mol,0.15molFe2+能够提供电子0.15mol,0.05molCl2能够获得电子0.1mol,小于0.15molFe2+能够提供电子0.15mol,Fe2+有剩余,符合题意,所以原溶液含有FeBr20.15mol,根据电子转移守恒,被氧化的Fe2+为0.05mol×2=0.1mol,生成Fe3+为0.1mol,剩余Fe2+为0.15mol-0.1mol=0.05mol,结合选项具体解答.
解答 解:还原性Fe2+>Br-,所以FeBr2溶液中通入Cl2,Cl2先将Fe2+氧化为Fe3+,Fe2+反应完毕,若Cl2有剩余,剩余Cl2再将Br-氧化为Br2,最后溶液中含有Br-,说明Cl2完全反应,转化为Cl-.1.12L(标态下)Cl2的物质的量为0.05mol,根据氯元素守恒可知n(Cl-)=0.1mol,则溶液中n(Br-)=3n(Cl-)=0.3mol;
若溶液中Br-参加反应,令溶液中FeBr2物质的量为xmol,则根据电子转移守恒,x+(2x-0.3)=0.1,解得x=$\frac{2}{15}$mol,$\frac{2}{15}$molFe2+的提供电子为$\frac{2}{15}$mol大于0.05molCl2能够获得电子0.1mol,且(2x-0.3)<0,不符合题意;
若溶液中Br-未参加反应,则原溶液中的Fe2+物质的量为0.15mol,0.15molFe2+能够提供电子0.15mol,0.05molCl2能够获得电子0.1mol,小于0.15molFe2+能够提供电子0.15mol,Fe2+有剩余,符合题意,所以原溶液含有FeBr20.15mol,根据电子转移守恒,被氧化的Fe2+为0.05mol×2=0.1mol,生成Fe3+为0.1mol,剩余Fe2+为0.15mol-0.1mol=0.05mol;
A、由上述分析可知,原溶液含有FeBr20.15mol,所以原溶液的浓度为$\frac{0.15mol}{1L}$=0.15mol/L,故A错误;
B、由上述分析可知,反应后溶液中生成Fe3+为0.1mol,反应后溶液中c(Fe3+)=$\frac{0.1mol}{1L}$=0.1mol/L,故B正确;
C、由上述分析可知,反应后溶液中生成Fe3+为0.1mol,反应后溶液中c(Fe3+)=$\frac{0.1mol}{1L}$=0.1mol/L,剩余Fe2+为0.15mol-0.1mol=0.05mol,所以c(Fe2+)=$\frac{0.05mol}{1L}$=0.05mol/L,故C错误;
D、由上述分析可知,原溶液含有FeBr20.15mol,原溶液中c(Br-)=$\frac{0.15mol×2}{1L}$=0.3mol/L,故D错误.
故选:B.
点评 考查氧化还原反应计算,难度较大,关键根据电子转移守恒及溶液中c(Br-)=3c(Cl-)关系判断原溶液中FeBr2物质的量.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:选择题
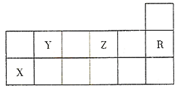
| A. | 热稳定性:Y的气态氢化物>Z的气态氢化物 | |
| B. | 简单离子半径比较Z小于X | |
| C. | X元素的单质能与所有强酸发生反应放出H2 | |
| D. | R的核外电子数与OH-的核外电子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| B. | 小苏打用于治疗胃溃疡病人的胃酸过多症 | |
| C. | 液氨汽化时要吸收大量的热,常用作制冷剂 | |
| D. | 纯净的二氧化硅是生产光纤制品的基本原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g乙烯中含有的电子总数为12NA | |
| B. | 1L0.1mol•L-1NaHCO3溶液中HCO3-和CO32-的离子数之和为0.1NA | |
| C. | 用铅蓄电池电解氯化钠溶液,若收集到11.2LCl2(标准状况),则至少转移电子数为NA | |
| D. | H2与Cl2反应生成22.4LHCl(标准状况),则断裂化学键的总数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Og化学性质稳定 | |
| B. | Nh的最高价氧化物的水化物属于强碱 | |
| C. | Ts的单质常温下是深色固体 | |
| D. | Mc有-3、+3、+5等价态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2 | B. | Cl2O | C. | ClO2 | D. | Cl2O7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,0.56 L丙烷中含有共价键的数目为0.2NA | |
| B. | 常温常压下,6.4 g氧气和臭氧中含有的原子总数为0.4NA | |
| C. | 5.6 g铁与一定量硝酸恰好反应,转移的电子数目一定为0.3NA | |
| D. | 常温下,2 L 0.1 mol•L-1Na2CO3溶液中,含有的CO32-离子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用热碱液清除炊具上残留的油污 | |
| B. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | |
| C. | 用含硅胶、铁粉的透气小袋和食品一起密封包装 | |
| D. | 用活性炭去除冰箱中的异味 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com